Nguyên tố Y có khả năng tạo thành ion Y2+. Trong cation Y2+, tổng số hạt cơ bản là 34 hạt, trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Số hiệu nguyên tử của Y là ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Theo giả thiết ta có: 2 Z X + 2 Z Y + N X + N Y = 142 ( 2 Z X + 2 Z Y ) - ( N X + N Y ) = 42 ⇔ Z X + Z Y = 46 ( 1 ) N X + N Y = 50 ( 2 )
Mặt khác ta lại có: Tỉ lệ số proton của ion X 2 + và ion Y 3 + là 10 13 ⇒ Z X Z Y = 10 13 ( 3 )
Từ (1) và (3) ta có Z X = 20 ( C a ) v à Z Y = 26 ( F e )
X có cấu hình electron là: 1s22s22p63s23p64s2.
⇒ X có 0 electron độc thân
Fe có cấu hình là 1s22s22p63s23p63d64s2
⇒ F e 3 + có cấu hình là 1s22s22p63s23p63d5
⇒ F e 3 + có 5 electron độc thân
Chú ý: Đây là một bài khá dễ nhưng sẽ có nhiều bạn mắc phải sai lầm đáng tiếc là khi đề cho giả thiết: Tỉ lệ số proton của ion X 2 + và ion Y 3 + là 10 13
Theo quán tính sẽ có rất nhiều bạn sẽ thành lập phương trình sau: Z X - 2 Z Y - 3 = 10 13 dẫn đến không tìm ra kết quả đúng. Ở đây giả thiết cho là proton (hạt mang điện trong hạt nhân) chứ không phải electron (hạt mang điện lớp vỏ). Vì vậy trong quá trình làm bài các bạn nên đọc thật kỹ đề và không nên làm theo quán tính đọc hiểu đề và tư duy ngay cách làm.


X có cấu hình electron là: 1s22s22p63s23p64s2.
⇒ X có 0 electron độc thân
Fe có cấu hình là 1s22s22p63s23p63d64s2
⇒ F e 3 + có cấu hình là 1s22s22p63s23p63d5
⇒ F e 3 + có 5 electron độc thân
Chú ý: Đây là một bài khá dễ nhưng sẽ có nhiều bạn mắc phải sai lầm đáng tiếc là khi đề cho giả thiết: Tỉ lệ số proton của ion X 2 + và ion Y 3 + là 10 13
Theo quán tính sẽ có rất nhiều bạn sẽ thành lập phương trình sau: Z X - 2 Z y - 3 = 10 13 dẫn đến không tìm ra kết quả đúng. Ở đây giả thiết cho là proton (hạt mang điện trong hạt nhân) chứ không phải electron (hạt mang điện lớp vỏ). Vì vậy trong quá trình làm bài các bạn nên đọc thật kỹ đề và không nên làm theo quán tính đọc hiểu đề và tư duy ngay cách làm.
Đáp án C

Chọn C
- Xác định X:
Theo bài ra ta có hệ phương trình:
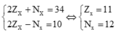
Cấu hình electron của X là: [Ne]3s1 → X là kim loại nhóm IA
X có xu hướng nhường 1e khi hình thành liên kết hóa học:
X → X+ + 1e
- Cấu hình electron của Y là: [He]2s22p5 → Y là phi kim nhóm VIIA hoặc từ kí hiệu nguyên tử xác định Y là Flo.
Y có xu hướng nhận 1e khi hình thành liên kết hóa học:
Y + 1e → Y-
Vậy hợp chất tạo thành là XY; liên kết trong hợp chất là liên kết ion.

X có cấu hình Electron: \(1s^22s^22p^63s^23p^4\) \(\rightarrow\) X thuộc ô 16, chu kì 3, nhóm VIA
Y có: \(\left\{{}\begin{matrix}p+e+n=40\\p+e-n=12\end{matrix}\right.\) \(\Rightarrow\) \(\left\{{}\begin{matrix}p=e=13\\n=14\end{matrix}\right.\) có cấu hình Electron \(1s^22s^22p^63s^23p^1\) \(\Rightarrow\) Y thuộc ô số 13, chu kì 3, nhóm IIIA
\(Z^{2+}\) có: p = 29 \(\Rightarrow\) p của Z cũng bằng 29 (= e) nên p có cấu hình electron: \(1s^22s^22p^63s^23p^64s^13d^{10}\)
Suy ra Z thuộc ô 29, chu kì 4, nhóm IB.
Chọn câu A.



Y2+ có : số hạt mang điện là [p + (e – 2)]
=> [p + (e – 2)] – n = 10
=> 2p – n = 12
Y2+ có 34 hạt cơ bản => Y có 34 + 2 = 36 hạt cơ bản
=> p + e + n = 2p + n = 36
=> p = 12 ( p là số hiệu nguyên tử của Y)
Bạn tham khảo nha
Y2+ có : số hạt mang điện là [p + (e – 2)]
=> [p + (e – 2)] – n = 10
=> 2p – n = 12
Y2+ có 34 hạt cơ bản => Y có 34 + 2 = 36 hạt cơ bản
=> p + e + n = 2p + n = 36
=> p = 12 ( p là số hiệu nguyên tử của Y)