1) Đốt cháy hoàn toàn 4,6 gam hợp chất A ( chứa C, H, O) cần dùng hết 6,72 lít O2 ở đktc thu được CO2 và hơi nước theo tỉ lệ số mol là 2:3. Hãy các định công thức hóa học của A. BIết tỉ khối của A so với khi Hiddro bằng 23
2) cho 12,6 gam hôn hợp kim loại gồm Mg và M( hóa trị III) vào dung dịch HCl dư, Phản ứng xong thu được 13,44 lít khí hiddro ở đktc
a) tính khối lượng muối khan thu được
b) tìm kim loại M, biết trong hỗn hợp kim loại, tỉ lệ số mol của kim loại Mg và M là 3:2
3) hôn hợp A chứa HCl và O2 có tỉ lệ số mol tương ứng là 1:4
a) tính phần trăm theo thể tích và phần trăm theo khối lượng của mỗi khí trong A
b) tính tỉ khối của hỗn hợp A so với không khí
c) trộn HCl và O2 theo tỉ lệ thể tích bao nhiêu để đc hỗn hợp khí có tỉ khối so với H2 bằng 16,75

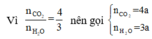
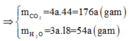
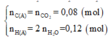

Bài 1/ Gọi CTHH của A là CxHyOz
\(C_xH_yO_z\left(0,1\right)+\left(x+\dfrac{y}{4}-\dfrac{z}{2}\right)O_2\left(0,1x+0,025y-0,05z\right)\rightarrow xCO_2\left(0,1x\right)+\dfrac{y}{2}H_2O\left(0,05y\right)\)
Ta có: \(A=12x+y+16z=23.2=46\left(1\right)\)
\(\Rightarrow n_A=\dfrac{4,6}{46}=0,1\left(mol\right)\)
Ta có: \(n_{O_2}=0,1x+0,025y-0,05z=\dfrac{6,72}{22,4}=0,3\left(2\right)\)
Thu được CO2 và hơi nước theo tỉ lệ số mol là 2:3 nên ta có:
\(\Rightarrow\dfrac{0,1x}{0,05y}=\dfrac{2}{3}\)
\(\Rightarrow y=3x\left(3\right)\)
Từ (1), (2), (3) ta có hệ: \(\left\{{}\begin{matrix}12x+y+16z=46\\0,1x+0,025y-0,05z=0,3\\y=3x\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=2\\y=6\\z=1\end{matrix}\right.\)
Vậy A là: C2H6O
Bài 2/
a/ Ta có: \(n_{Cl}=2.n_{H_2}=2.\dfrac{13,44}{22,4}=1,2\left(mol\right)\)
\(\Rightarrow m_{Cl}=1,2.35,5=42,6\left(g\right)\)
\(\Rightarrow m_{muoi}=12,6+42,6=55,2\left(g\right)\)
b/ Gọi số mol của Mg và M lần lược là x, y
\(Mg\left(x\right)+2HCl\rightarrow MgCl_2+H_2\left(x\right)\)
\(2M\left(y\right)+6HCl\rightarrow MCl_3+3H_2\left(1,5y\right)\)
Ta có: \(\left\{{}\begin{matrix}24x+My=12,6\\x+1,5y=0,6\\\dfrac{x}{y}=\dfrac{3}{2}\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,3\\y=0,2\\M=27\end{matrix}\right.\)
Vậy M là Al
\(\)