Cho 15,6g benzen tác dụng với Brom thu được 14,8g brombenzen. tính hiệu suất của quá trình phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{C_6H_5Cl}=\dfrac{78}{112,5}=\dfrac{52}{75}\left(mol\right)\)
\(n_{C_6H_6}=\dfrac{78}{78}=1\left(mol\right)\)
PTHH:
\(C_6H_6+Cl_2\xrightarrow[t^o]{Fe}C_6H_5Cl\)
1------------------>1
\(\Rightarrow H=\dfrac{\dfrac{52}{75}}{1}.100\%=69,33\%\)

nC6H5Br=\(\frac{3,925}{6.12+5+80}\)=0,025(mol)
PTHH: C6H6+Br2 \(\xrightarrow[t^o]{Fe}\) C6H5Br + HCl
(mol) 0,025 0,025 0,025
mC6H6=\(\frac{0,025.\left(12x6+6\right)}{75\%}\)=2,6 (g)
mBr2=\(\frac{0,025.160}{75\%}\)=5,3(g)

nC6H6 = 0,3 mol
C6H6 + Br2 → C6H5Br + HBr
0,3........................0,3
⇒ mC6H5Br = 0,3.157.\(\dfrac{90}{100}\) = 42,39 (g)

Phương trình hoá học của phản ứng giữa benzen và clo
C 6 H 6 + Cl 2 → t ° C 6 H 5 Cl + HCl
Theo phương trình hoá học : số mol C 6 H 6 = số mol C 6 H 5 Cl
Vì hiệu suất 80% và clo dư nên số mol clobenzen thu được là :
n C 6 H 5 Cl = 15,6/78 x 80/100 = 0,16mol
=> m C 6 H 5 Cl = 0,16 x 112,5 = 18g

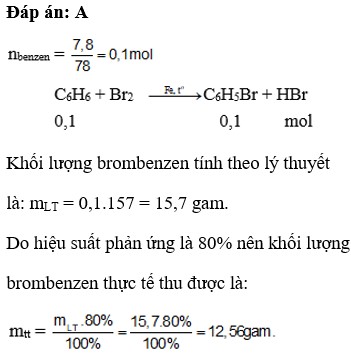
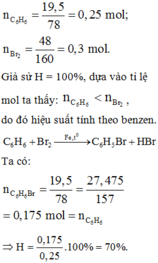


C6H6 + Br2 --(Fe, nhiệt)--> C6H5Br + HBr
nC6H6 = \(\frac{15,6}{78}\) = 0,2 mol
nC6H5Br (lý thuyết) = 0,2 (mol)
mC6H5Br (lý thuyết) = 0,2.157 = 31,4 (g)
H = \(\frac{14,8.100}{31,4}\)=47,13 %