Hoà tan hoàn toàn một oxit kim loại hoá trị II bằng dung dịch H2SO4 14% vừa đủ thì thu được một dung dịch muối có nồng độ 16,2%. Xác định công thức của oxit trên.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử CTHH của oxit kim loại hóa trị II là: MO, có a (mol)
PTHH: MO+H2SO4 → MSO4+H2O
a a a (mol)
mMO=(M+16)a=aM+16a (g)
mH2SO4=98a (g)
→ mdd H2SO4=(98a/14).100=700a (g)
mdd spư=mMO+mdd H2SO4=aM+716a (g)
mMSO4=a.(M+96)=aM+96a (g)
C% MSO4=16,2% →(aM+96a)/(aM+716a).100=16,2
→(M+96)/(M+716)=0,162
→M≈24 →M: Mg
Vậy CTHH của oxit là: MgO
*Tk

Chọn C
Gọi công thức của oxit hóa trị II là RO
Đặt mol RO = 1 (mol)
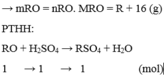
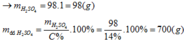
![]()
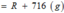
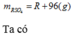

Vậy công thức của oxit kim loại là MgO

Gọi CT của oxit : RO
n RO = a ( mol )
PTHH:
RO + H2SO4 ====> RSO4 + H2O
a--------a------------------a
theo pthh:
n H2SO4 = n RSO4 = n RO = a ( mol )
Có: n H2SO4=a ( mol ) => m H2SO4 = 98a ( g )
=> m dd H2SO4 20% = 490a ( g )
BTKL: m dd sau phản ứng = a ( R + 16 ) + 490a = aR + 506a ( g )
Lại có :
n RSO4 = a ( mol ) => m RSO4 = aR + 96a
=> \(\dfrac{aR+96a}{aR+506a}=\dfrac{22,64}{100}\Rightarrow\dfrac{a\left(R+96\right)}{a\left(R+506\right)}=\dfrac{22,64}{100}\)
\(\Rightarrow R=24\left(Mg\right)\)
Vậy CT: MgO

\(Đặt.oxit:A_2O_3\\ A_2O_3+3H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3H_2O\\ n_{Al_2O_3}=\dfrac{34,2-10,2}{96.3-16.3}=0,1\left(mol\right)\\ M_{A_2O_3}=\dfrac{10,2}{0,1}=102\left(\dfrac{g}{mol}\right)=2M_A+48\\ \Rightarrow M_A=27\left(\dfrac{g}{mol}\right)\\ a,\Rightarrow A.là.nhôm\left(Al=27\right)\\ b,n_{H_2SO_4}=3.0,1=0,3\left(mol\right)\\ C\%_{ddH_2SO_4}=\dfrac{0,3.98}{100}.100=29,4\%\\ c,n_{Al_2\left(SO_4\right)_3}=n_{Al_2O_3}=0,1\left(mol\right)\\ Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\\ n_{NaOH}=6.0,1=0,6\left(mol\right)\\ V_{ddNaOH}=\dfrac{0,6}{1,5}=0,4\left(l\right)\)

CT oxit : MO
Đặt số mol oxit phản ứng là 1 mol
\(MO+H_2SO_4\rightarrow MSO_4+H_2O\)
\(m_{ddH_2SO_4}=\dfrac{1.98}{15,8\%}=620,25\left(g\right)\)
\(m_{ddsaupu}=620,25+M+16=M+636,25\left(g\right)\)
Ta có : \(C\%_{MSO_4}=\dfrac{M+96}{M+636,25}.100=22,959\)
=> M=65 (Zn)
=> Oxit kim loại : ZnO (Kẽm oxit)

Giả sử hòa tan 1 mol R2On
PTHH: R2On + nH2SO4 --> R2(SO4)n + nH2O
1------>n----------->1-------->n
=> mH2SO4 = 98n (g)
=> \(m_{dd.H_2SO_4}=\dfrac{98n.100}{10}=980n\left(g\right)\)
\(m_{R_2\left(SO_4\right)_n}=2.M_R+96n\left(g\right)\)
mdd sau pư = mR2On + mdd H2SO4
= 2.MR + 16n + 980n = 2.MR + 996n (g)
\(C\%_{muối}=\dfrac{2.M_R+96n}{2.M_R+996n}.100\%=12,9\%\)
=> \(M_R=\dfrac{16242}{871}n\left(g/mol\right)\)
Chỉ có n = 3 thỏa mãn => MR = 56 (g/mol)
=> R là Fe
CTHH của oxit là Fe2O3

Giả sử hòa tan 1 mol R2On
PTHH: R2On + nH2SO4 --> R2(SO4)n + nH2O
1------>n----------->1-------->n
=> mH2SO4 = 98n (g)
=> \(m_{dd.H_2SO_4}=\dfrac{98n.100}{10}=980n\left(g\right)\)
\(m_{R_2\left(SO_4\right)_n}=2.M_R+96n\left(g\right)\)
mdd sau pư = mR2On + mdd H2SO4
= 2.MR + 16n + 980n = 2.MR + 996n (g)
\(C\%_{muối}=\dfrac{2.M_R+96n}{2.M_R+996n}.100\%=12,9\%\)
=> \(M_R=\dfrac{16242}{871}n\left(g/mol\right)\)
Chỉ có n = 3 thỏa mãn => MR = 56 (g/mol)
=> R là Fe
CTHH của oxit là Fe2O3

a/ CT oxit: $CuO$
b/ Vậy CT X: $CuSO_4.5H_2O$
Giải thích các bước giải:
Gọi công thức oxit là: $MO$
Số mol oxit là a mol
$MO+H_2SO_4\to MSO_4+H_2O$
Theo PTHH
$n_{H_2SO_4}=n_{MSO_4}=n_{MO}=a\ mol$
$⇒m_{dd\ H_2SO_4}=\dfrac{98a.100}{24,5}=400a$
$⇒m_{dd\ A}=a.(M+16)+400a = aM+416a$
$m_{MSO_4}=a.(M+96)$
Do nồng độ muối là 33,33% nên:
$\dfrac{a.(M+96)}{aM+416a}.100\%=33,33\\⇒M=64$
Vậy M là Cu, công thức oxit: $CuO$
b.
Trong 60 gam dung dịch muối A có:
$m_{CuSO_4}=\dfrac{60.33,33}{100}=20g$
Gọi công thức tinh thể tách ra là: $CuSO_4.nH_2O$
Khối lượng dung dịch còn lại là:
$60-15,625=44,375g ⇒ m_{CuSO_4\ trong\ dd}=\dfrac{44,375.22,54}{100}=10g$
$⇒m_{CuSO_4\ trong\ tinh\ thể}=20-10=10g$
$⇒n_{tinh\ thể}=n_{CuSO_4}=0,0625\ mol$
$⇒M_{tinh\ thể}=15,625:0,0625=250⇒n=5$
Vậy CT X: $CuSO_4.5H_2O$
gọi công thức một oxit kim loại hóa trị II là:RO
-giả sử có 1 mol:RO
⇒m RO=1.(R+16)=R+16 g
RO+H2SO4→RSO4+H2O
1→ 1 1 1 mol
/
m ct H2SO4=1.98=98 g
mdd H2SO4=98.1001498.10014=700 g
/
mdd sau pứ=m RO+m H2SO4
=R+16+700=R+716 g
m ct RSO4=1.(R+96)=R+96 g
⇒C% RSO4=R+96R+716R+96R+716.100=16,2
⇔R+96R+716R+96R+716.100=16,2
⇔R≈24 g/mol
⇒R là nguyên tố Magie (Mg)
CT oxit: MgO