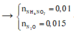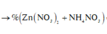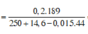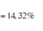hòa tan hoàn toàn hỗn hợp gồm Zn , ZnO bằng dung dịch HNO3 loãng , dư . kết thúc thí nghiệm không có khí thoát ra , dung dịch thu được chứa 8 gam NH4NO3 và 113,4 gam Zn(NO3)2 . phần trăm số mol Zn có trong hỗn hợp ban đầu là bao nhiêu ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nZn(NO3)2 = 0,6
nNH4NO3 = 0,1
Áp dụng định luật bảo toàn e có: 2nZn = 8nNH4NO3 ⇒ nZn = 0,4
⇒ nZnO = nZn(NO3)2 – nZn = 0,6 – 0,4 =0,2
⇒ %mZn = mZn ÷ mX .100% = 61,61%
Đáp án C.

Ta có nZn = nZnO = 0,1 mol, nHNO3 = 0,5 mol
Kết tủa thu được là Zn(OH)2: 0,06 mol
Vậy dung dịch sau phản ứng + KOH chứa K2ZnO2: (0,1 + 0,1 - 0,06) = 0,14 mol và KNO3: (0,74 - 2 × 0,14) = 0,46 mol
Bảo toàn nguyên tố N → nN (Y) + nNH4 + = 0,5 - 0,46 = 0,04 mol
Nếu khí Y chứa 1 nguyên tố N (NO và NO2) → nNH4+ = 0,04 - 0,015 = 0,025
Bảo toàn electron → số electron trao đổi của Y là: 0,1×2−0,025×80,015 = 0 (Vô lý)
Vậy khí Y chứa 2 nguyên tố N (N2, N2O) → nNH4+ = 0,04 - 0,015 × 2 = 0,01 mol
Bảo toàn electron → số electron trao đổi của Y là: 0,1×2−0,01×80,015 = 8 → khí tạo thành là N2O
Bảo toàn khối lượng → mdd = 14,6 + 250 - 0,015 × 44 = 263,94 gam
C% Zn(NO3)2 = (0,2×189/ 263,94 )×100% = 14,32%
Đáp án C

Chọn đáp án D
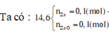


Có NH4NO3 vì nếu Y là N2 ![]()
Sau khi cho KOH vào thì K nó chạy đi đâu?Việc trả lời câu hỏi này sẽ giúp ta tiết kiệm rất nhiều thời gian và không cần quan tâm HNO3 thừa thiếu thế nào.
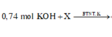

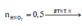
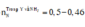
![]()