Câu 2:
Hỗn hợp X gồm Fe và Cu. Chia X thành hai phần bằng nhau:
Phần 1: tác dụng với dung dịch HCl dư, thu được 2,24 lít khí H2.
Phần 2: tác dụng với dung dịch H2SO4 đặc, nóng, dư thu được 8,96 lít khí SO2.
Biết thể tích các khí đều đo ở điều kiện tiêu chuẩn. a) Viết các phương trình hóa học xảy ra.
b) Tính thành phần % theo khối lượng của mỗi kim loại trong hỗn hợp X.
Cho biết nguyên tử khối của các nguyên tố: Fe = 56, Cu = 64.


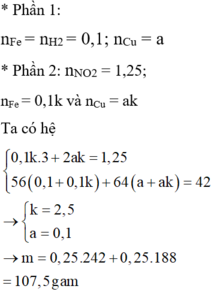
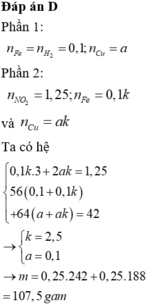
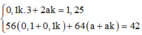
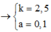

P1 :\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: nH2 = nFe = 0,1 mol
P2 :2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O (1)
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O (2)
Ta có: \(\dfrac{3}{2}.0,1\) + nSO2(2) = 0,4 mol
=> x = 0,1 ; y = 0,25 mol
Do chia 2 hỗn hợp X thành phần bằng nhau nên trong gam X có: 0,2 mol Fe và 0,5 mol Cu
=> \(\%m_{Fe}=\dfrac{0,2.56}{0,2.56+0,3.64}.100=36,84\%\)
%m Cu=63,16%