nhúng một thanh sắt 8g vào 500ml dung dịch CuSO4 nồng độ 2M.Sau một thời gian lấy ra thấy thanh sắt nặng 8,8g. tính nồng độ mol của dung dịch sau phản ứng. Coi thể tích thay đổi không đáng kể
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


trên mạng mk thấy có một bài tượng tự trên hocmai, bạn vào đó tham khảo nhé
Nhưng mà bài đó không phải là tính số mol mà tính nồng độ phần trăm mình xem bài đó rồi bạn

\(n_{Fe.pu}=x\)
\(n_{Fe}=\frac{8}{56}=\frac{1}{7}\left(mol\right)\)
\(PTHH:Fe+CuSO_4\rightarrow Cu+FeSO_4\)
(mol) x x x x
Theo đề bài ta có:
\(64x-56x=8,8-8\Leftrightarrow x=\frac{0,8}{8}=0,1\left(mol\right)\)
\(m_{Cu}=64x=64.0,1=6,4\left(g\right)\\ m_{Fe.du}=\left(\frac{1}{7}-0,1\right).56=2,4\left(g\right)\)
\(V_{ddspu}=22,4.0,1+0,5-22,4.0,1=0,5\left(l\right)\)
\(C_{M_{FeSO_4}}=\frac{0,1}{0,5}=0,2\left(M\right)\)
\(C_{M_{CuSO_4}}=\frac{\left(2.0,5\right)-0,1}{0,5}=1,8\left(M\right)\)


Theo (1) có khối lượng Cu bám vào: mCu = 0,4.2,5.64 = 64 (gam)
Theo (2) có khối lượng Cu bám vào: mCu = 0,4.64 =25,6 (gam).
Đáp án A

nCu= \(\frac{0,64}{64}\) = 0,01 mol
PTHH:
Fe + CuSO4 → FeSO4 + Cu↓
0,01___0,01_____________0,01
\(\text{m t h a n h s ắ t t ă n g = 0,01 . (64- 56)=0,08 g}\)
a=\(\frac{0,08}{50}\).100%=0,16 %'
\(CM_{CuSO4}=\frac{0,01}{0,5}=0,02M\)

Al: 25 gam + 0,1 mol CuSO4 → thanh nhôm nặng 25,69 gam.
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Sau phản ứng mtăng = 25,69 - 25 = 0,69 gam
=> \(n_{Al} = 2. \dfrac{0,69}{3 .64 - 2 . 27} = 0,01 mol\)
=> nAl2(SO4)3 = 0,005 mol; nCuSO4dư = 0,1 - 0,015 = 0,085 mol
=> CM Al2(SO4)3= 0,025 M; CM CuSO4 = 0,425 M

n C u S O 4 = 0,5.0,2 = 0,1 mol
2 A l + 3 C u S O 4 → A l 2 S O 4 3 + 3 C u
2x……3x……..x……3x (Mol)
Theo bài ta có:
m C u b á m v à o - m A l tan = m A l t ă n g
⇔ 3x.64 - 2x.27 = 25,69 - 25
⇔ 138x = 0,69
⇔ x = 0,005 mol
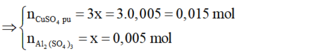

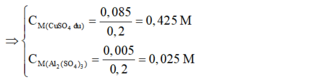
⇒ Chọn D.

\(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\\ Đặt:n_{Al\left(pứ\right)}=x\left(mol\right)\\ m_{tăng}=m_{Cu\left(sinhra\right)}-m_{Al\left(pứ\right)}=\dfrac{3}{2}x.64-x.27=25,69-25\\ \Rightarrow x=0,01\left(mol\right)\\ \Rightarrow n_{CuSO_4\left(dư\right)}=0,2.0,5-0,01.\dfrac{3}{2}=0,085\left(mol\right)\\ n_{Al_2\left(SO_4\right)_3}=0,01\left(mol\right)\\ CM_{Al_2\left(SO_4\right)_3}=\dfrac{0,01}{0,2}=0,05\left(M\right)\\ CM_{CuSO_4\left(dư\right)}=\dfrac{0,085}{0,2}=0,475M\)
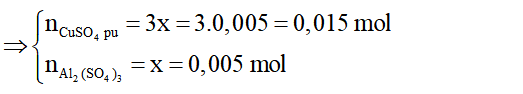
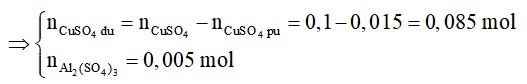
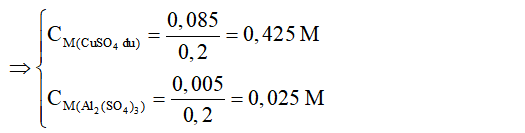
Gọi $n_{Fe\ pư} = a(mol)$
$Fe + CuSO_4 \to FeSO_4 + Cu$
$n_{Cu} = n_{Fe} = a(mol)$
Suy ra: $8 - 56a + 64a = 8,8 \Rightarrow a = 0,1(mol)$
$n_{FeSO_4} = n_{Fe} =a = 0,1(mol)$
$n_{CuSO_4\ dư} = 0,5.2 - 0,1 = 0,9(mol)$
$C_{M_{FeSO_4}} = \dfrac{0,1}{0,5} = 0,2M$
$C_{M_{CuSO_4}} = \dfrac{0,9}{0,5} = 1,8M$