1 loại thủy tinh có thành phần hóa học được biểu diễn bằng công thức K2O.PbO.6SiO2 . tính khối lượng K2CO3 , PbCO3 và SiO2 cần dùng để có thể sản xuất được 6,77 tấn thủy tinh trên . coi hiệu suất của quá trình là 100% .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{thủy-tinh}=\dfrac{6,77.1000}{677}=10\left(kmol\right)\\ n_{K_2CO_3}=n_{PbCO_3}=n_{ttinh}=10\left(kmol\right)\\ n_{SiO_2}=6n_{ttinh}=60\left(kmol\right)\)
Suy ra:
\(m_{K_2CO_3}=10.138=1380\left(kg\right)\\ m_{PbCO_3}=10.267=2670\left(kg\right)\\ m_{SiO_2}=60.60=3600\left(kg\right)\)

Số mol thuỷ tinh là:
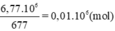
Từ công thức của thuỷ tinh suy ra:
nK2CO3 = nPbCO3 = nthuỷ tinh = 0,01.106 mol
Khối lượng K2CO3 = 0,01. 106. 138(g) = 1,38. 106(g) = 1,38 (tấn)
Khối lượng PbCO3 = 0,01. 106. 267(g) = 2,67. 106(g) = 2,67(tấn)
nSiO2 = 6nthuỷ tinh = 6. 0,01. 106 mol = 0,06. 106 mol
Khối lượng SiO2 = 0,06. 106. 60(g) = 3,6 tấn

Khối lượng 1 mol phân tử thủy tinh K2O.PbO.6SiO2 là 677g
=
x 138 = 1,38 (tấn)
=
x 267 = 2,67 (tấn)
=
x 6 x 60,0 = 3,6 (tấn)
Để nấu được 6,77 tấn thủy tinh trên cần dùng 13,8 tấn K2CO3, 2,67 tấn PbCO3 và 3,6 tấn SiO2.

Khối lượng 1 mol phân tử thủy tinh K2O.PbO.6SiO2 là 677g
=
x 138 = 1,38 (tấn)
=
x 267 = 2,67 (tấn)
=
x 6 x 60,0 = 3,6 (tấn)

Khối lượng 1 mol phân tử thủy tinh K2O.PbO.6SiO2 là 677g
=
x 138 = 1,38 (tấn)
=
x 267 = 2,67 (tấn)
=
x 6 x 60,0 = 3,6 (tấn)
Để nấu được 6,77 tấn thủy tinh trên cần dùng 13,8 tấn K2CO3, 2,67 tấn PbCO3 và 3,6 tấn SiO2

6 S i O 2 + C a C O 3 + N a 2 C O 3 → N a 2 O . C a O .6 S i O 2 + 2 C O 2 106 g → 478 g m N a 2 C O 3 → 120 k g
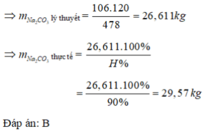

Gọi công thức của thuỷ tinh đó là: xNa2O.yCaO.zSiO2
Ta có khối lượng của các oxit tỉ lệ với thành phần phần trăm:
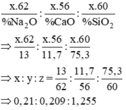
Ta quy về các số nguyên tối giản bằng cách chia cho số nhỏ nhất trong các giá trị trên (0,209) ⇒ x : y : z = 1 : 1 : 6
⇒ B đúng

Đáp án A
Tỷ lệ số mol của các oxit: nNa2O : nCaO : nSiO2 = 13/62 = 11,7/56 = 75,3/60
= 0,21 : 0,21 : 1,255 = 1:1:6
Vậy công thức của loại thủy tinh này: Na2O.CaO. 6SiO2
