Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vì các phản ứng hoàn toàn mà khi cho Y + NaOH ----> H2 chứng tỏ Al dư, Fe2O3 chuyển hết thành Fe. Vậy trong Y có chứa Al: 0,03 mol ( nH2 = 3/2nAl); nFe = 0,06 mol (mFe = m rắn = 3,36 g)
Từ pư: 2Al + Fe2O3 ---> Al2O3 + 2Fe => nFe2O3 = nAl2O3, mà nFe2O3 = nFe/2 => nAl2O3 = 0,03 mol
m phần 1 = 7,23 g => m phần 2 = 21,69 g. Hay p2 = 3 p1
=> Trong phần 2 có: Al: 0,09 mol; Fe: 0,18 mol; Al2O3: 0,09 mol
Bảo toàn e (giả sử chỉ tạo Fe2+, vì ta chưa biết sản phẩm có Fe3+ hay không): 3nNO < 3nAl + 2nFe => có NH4+
Gọi số mol Fe2+: x, Fe3+: y, NH4+: z
=> Bảo toàn electron: 0,09.3 + 2x + 3y = 0,17.3 + 8z
x + y = 0,18 (bảo toàn Fe)
1,52 = 0,09.3.2 ( nH+ phản ứng với Al2O3) + 0,17.4 + 10z
=> x = 0,06; y = 0,12; z = 0,03
Bảo toàn N: nNO3- = nHNO3 - nNO - nNH4+ = 1,32 mol
=> m = 21,69 + NO3- = 103,53 g

Fe3O4 + 8HCl --> FeCl2 + 2FeCl3 + 4H2O
_a_______8a______a_____2a______4a_
Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
_b______6b_______2b_____3b_
FeO + 2HCl --> FeCl2 + H2O
_c____2c_______c______c_
Fe + 2HCl --> FeCl2 + H2
_d___2d________d________d_
H2 + CuO --> Cu + H2O
_d____d_____d_____d_
nCuO = 3.2 / 80 = 0.04
=> d = 0.04
mHCl = 360 * 18.25 / 100 = 65.7 (g)
nHCl = 65.7 / 36.5 = 1.8 (mol)
=> 8a + 6b + 2c + 2d = 1.8
=> 8a + 6b + 2c + 0.08 = 1.8
=> 8a + 6b + 2c = 1.72
=> 4a + 3b + c = 0.86
a)
theo đlbtkl ta có
mHCl + mhh = mmuối + mH2O + mH2
65.7 + 57.6 = mmuối + 0.86 * 18 + 0.04 * 2
=> mmuối = 107.74 (g)
b) Fe3O4 + 8HCl --> FeCl2 + 2FeCl3 + 4H2O
_a_______8a______a_____2a______4a_
Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
_b______6b_______2b_____3b_
FeO + 2HCl --> FeCl2 + H2O
_b____2b_______b______b_
Fe + 2HCl --> FeCl2 + H2
0.2__0.4_______0.2____0.2
nH2 = nFe = 0.2
232a + 232b =57.6-0.2X56
8a + 8b = 1.8-0.2X2
vô nghiệm vì nFe2O3 =nFeO tuong đương 2ẩn cung M

PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
a) Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)=n_{Fe}\)
\(\Rightarrow m_{Fe}=0,2\cdot56=11,2\left(g\right)\) \(\Rightarrow m_{Fe_2O_3}=16\left(g\right)\)
b+c) Ta có: \(\left\{{}\begin{matrix}n_{Fe}=0,2\left(mol\right)\\n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{HCl}=2n_{Fe}+6n_{Fe_2O_3}=1\left(mol\right)\) \(\Rightarrow m_{ddHCl}=\dfrac{36,5}{20\%}=182,5\left(g\right)\)
Mặt khác: \(n_{FeCl_2}=0,2\left(mol\right)=n_{H_2}=n_{FeCl_3}\) \(\Rightarrow\left\{{}\begin{matrix}m_{FeCl_2}=0,2\cdot127=25,4\left(g\right)\\m_{FeCl_3}=0,2\cdot162,5=32,5\left(g\right)\\m_{H_2}=0,2\cdot2=0,4\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{dd}=m_{hhA}+m_{ddHCl}-m_{H_2}=209,3\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeCl_2}=\dfrac{25,4}{209,3}\cdot100\%\approx12,14\%\\C\%_{FeCl_3}=\dfrac{32,5}{209,3}\cdot100\%\approx15,53\%\end{matrix}\right.\)
\(n_{H2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,2 0,4 0,2 0,2
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O|\)
1 6 2 3
0,1 0,6 0,2
a) \(n_{Fe}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(m_{Fe}=0,2.56=11,2\left(g\right)\)
\(m_{Fe2O3}=27,2-11,2=16\left(g\right)\)
b) Có : \(m_{Fe2O3}=16\left(g\right)\)
\(n_{Fe2O3}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(n_{HCl\left(tổng\right)}=0,4+0,6=1\left(mol\right)\)
⇒ \(m_{HCl}=1.36,5=36,5\left(g\right)\)
\(m_{ddHCl}=\dfrac{36,5.100}{20}=182,5\left(g\right)\)
c) \(n_{FeCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{FeCl2}=0,2.127=25,4\left(g\right)\)
\(n_{FeCl3}=\dfrac{0,6.2}{6}=0,2\left(mol\right)\)
⇒ \(m_{FeCl3}=0,2.162,5=32,5\left(g\right)\)
\(m_{ddspu}=27,2+182,5-\left(0,2.2\right)=209,3\left(g\right)\)
\(C_{FeCl2}=\dfrac{25,4.100}{209,3}=12,14\)0/0
\(C_{FeCl3}=\dfrac{32,5.100}{209,3}=15,53\)0/0
Chúc bạn học tốt

\(a,Mg+2HCl\rightarrow MgCl_2+H_2\\ MgO+2HCl\rightarrow MgCl_2+H_2O\\ n_{Mg}=n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ \Rightarrow m_{Mg}=0,2.24=4,8\left(g\right)\\ \Rightarrow m_{MgO}=m_{hhA}-m_{Mg}=6,8-4,8=2\left(g\right)\\ c,n_{MgO}=\dfrac{2}{40}=0,05\left(mol\right)\\ n_{HCl}=2.\left(n_{Mg}+n_{MgO}\right)=2.\left(0,2+0,05\right)=0,5\left(mol\right)\\ \Rightarrow V_{ddHCl}=\dfrac{0,5}{2}=0,25\left(l\right)\)

a)
Gọi $n_{Fe_3O_4} = a(mol) ; n_{ZnO} = b(mol)$
Ta có : 232a + 81b = 70,7(1)
$Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O$
$ZnO + H_2 \xrightarrow{t^o} Zn + H_2O$
$Fe + 2HCl \to FeCl_2 + H_2$
$Zn + 2HCl \to ZnCl_2 + H_2$
Theo PTHH :
$n_{H_2} = 3a + b = \dfrac{20,16}{22,4} = 0,9(mol)(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,3
%\%m_{Fe_3O_4} = \dfrac{0,2.232}{70,7}.100\% = 65,6\%$
$\%m_{ZnO} = \dfrac{0,3.81}{70,7}.100\% = 34,4\%$
b)
$n_{HCl} = 2n_{H_2} = 1,8(mol) \Rightarrow m_{dd\ HCl} = \dfrac{1,8.36,5}{14,6\%} = 450(gam)$
$m_{dd\ B} = 0,2.3.56 + 0,3.65 + 450 - 0,9.2 = 501,3(gam)$
$C\%_{FeCl_2} = \dfrac{0,6.127}{501,3}.100\% = 15,2\%$
$C\%_{ZnCl_2} = \dfrac{0,3.136}{501,3}.100\% = 8,14\%$
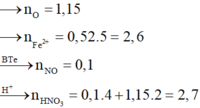
Giả sử hh hết
MgO + 2HCl \(\rightarrow\) MgCl2 + H2O (1)
0,1 \(\rightarrow\) 0,2 (mol)
Fe2O3 + 6HCl \(\rightarrow\) 2FeCl3 + 3H2O (2)
0,1 \(\rightarrow\) 0,6 (mol)
nHCl pư = 0,8 > 0,4 (mol)
=> Giả sử sai
=|>HCl hết
Gọi số mol MgO , Fe2O3 pư lần lượt là x , y
Theo pt (1),(2) nHCl = 2x + 6y = 0,4 (mol) (l)
Tỉ lệ số mol của MgO : Fe2O3 ban đầu là tỉ lệ MgO : Fe2O3 pư
=> \(\frac{x}{y}\) = \(\frac{0,1}{0,1}\) = 1 (ll)
Giải hệ pt (l) ,(ll)=> x=y=0,05
=|> Mmuối = 0,05 . 95 + 0,05 . 2 . 162,5 = 21 (g)
mMgCl2 = 0,05 . 95 = 4,75
mFeCl3 = 16,25