Hột hợp chất A gồm FeS2;FeS;CuS được hòa tan vừa đủ trong một dung dịch có chứa 0,33molH2SO4 đặc nóng . Thu được 7,28lítSO2(đktc) và dung dịch B . Nhúng một thanh sắt nặng 50gam vào dung dịch B , phản ứng xong nhấc thanh sắt ra đem cân thấy khối lượng thanh sắt lúc này là 49,48 và còn lại dd C .
a) Xác định khối lượng các chất có trong A ( coi lượng đồng được đẩy ra bám hết lên thanh sắt )
b) Viết PTPƯ xảy ra (nếu có ) khi cho dd C lần lượt tác dụng với dd NaOH;ddK2S;khíCl2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\left\{{}\begin{matrix}FeS_2:x\left(mol\right)\\Cu_2S:y\left(mol\right)\end{matrix}\right.\)
4FeS2 + 11O2 \(\xrightarrow{t^o}\) 2Fe2O3 + 8SO2
x..............................0,5x.........2x...................(mol)
Cu2S + 2O2 \(\xrightarrow{t^o}\) 2CuO + SO2
y..........................2y...........y.............................(mol)
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
0,5x...........1,5x..................................................(mol)
CuO + H2SO4 → CuSO4 + H2O
2y............2y.................................................(mol)
Suy ra: 1,5x + 2y = 0,2.2,5(1)
SO2 + 2NaOH → Na2SO3 + H2O
(2x+y).....(4x+2y).........................................(mol)
Suy ra : 4x + 2y = 0,25.4(2)
Từ (1)(2) suy ra x = 0,2 ; y = 0,1
Vậy :
\(\%m_{FeS_2} = \dfrac{0,2.120}{0,2.120+0,1.160}.100\% = 60\%\\ \%m_{Cu_2S} = 100\% -60\% = 40\%\)

Đáp án D
Số mol của SO2 thu được là: n SO 2 = 1 , 6 mol
Đặt số mol các chất trong A là FeS2: a mol; ZnS : b mol
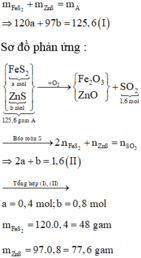

Đốt cháy:
\(4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\)
\(Ag_2S+O_2\underrightarrow{t^o}2Ag+SO_2\)
\(\Rightarrow A\left\{{}\begin{matrix}Fe_2O_3\\Ag\end{matrix}\right.\)
\(B:SO_2\)
\(SO_2+Br_2+H_2O\rightarrow H_2SO_4+HBr\)
Dung dịch C \(\left\{{}\begin{matrix}H_2SO_4\\HBr\end{matrix}\right.\)
Cho A vào ddC:
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2\)
\(Fe_2O_3+6HBr\rightarrow2FeBr_3+3H_2O\)

a, PT: \(4FeS+7O_2\underrightarrow{t^o}2Fe_2O_3+4SO_2\)
\(4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\)
Giả sử: \(\left\{{}\begin{matrix}n_{FeS}=x\left(mol\right)\\n_{FeS_2}=y\left(mol\right)\end{matrix}\right.\)
⇒ 88x + 120y = 17,8 (1)
Ta có: \(n_{SO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Theo PT: \(n_{SO_2}=n_{FeS}+2n_{FeS_2}=x+2y\left(mol\right)\)
⇒ x + 2y = 0,25 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,075\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{FeS}=0,1.88=8,8\left(g\right)\\m_{FeS_2}=0,075.120=9\left(g\right)\end{matrix}\right.\)
b, Theo PT: \(n_{O_2}=\dfrac{7}{4}n_{FeS}+\dfrac{11}{4}n_{O_2}=0,38125\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,38125.22,4=8,54\left(l\right)\)
Bạn tham khảo nhé!
a) Gọi nFeS = a (mol)
\(n_{FeS_2}=b\left(mol\right)\) với a; b > 0
\(n_{SO_2}=\dfrac{V}{22,4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Ta có: \(\left\{{}\begin{matrix}m_{hh}=17,8=m_{FeS}+m_{FeS_2}=88a+120b\\n_{S\left(SO_2\right)}=0,25=n_{FeS}+2n_{FeS_2}\left(bt\left[S\right]\right)=a+2b\end{matrix}\right.\)
=> a = 0,1(mol); b = 0,075(mol)
mFeS= n.M= 0,1 . 88 = 8,8(g)
=> \(m_{FeS_2}=m_{hh}-m_{FeS}=17,8-8,8=9\left(g\right)\)
b) PT:
\(4FeS+7O_2\underrightarrow{t^o}2Fe_2O_3+4SO_2\uparrow\\ 4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\uparrow\)
\(Theo2pt\Rightarrow n_{O_2}=\dfrac{7n_{FeS}+11n_{FeS_2}}{4}=0,38125\left(mol\right)\)
\(\Rightarrow V_{O_2}=n\cdot22,4=0,38125\cdot22,4=8,54\left(l\right)\)




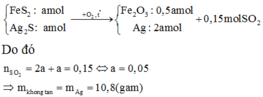
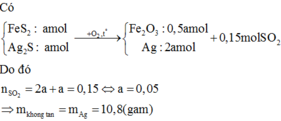
a )2 FeS2 + 14 H2SO4 => Fe2(SO4)3 + 15 SO2 +14 H2O