Hòa tan 8,862 gam hỗn hợp gồm Al và Mg vào dung dịch HNO3 loãng thu đc dung dịch X và hỗn hợp Y gồm 2 khí không màu, trong đó có một khí hóa nâu ngoài không khí. Khối lượng của Y là 5,18 gam. Cho NaOH dư vào dd X không thấy có khí thoát ra. Phần trăm khối lượng của Al trong hỗn hợp ban đầu là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Cho dung dịch NaOH (dư) vào X và đun nóng, không có khí mùi khai thoát ra
⇒ Không có sản phẩm khử NH4NO3.
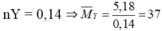
Khí không màu hóa nâu trong không khí là NO (M = 30 < 37)
⇒ Khí không màu còn lại có M > 37, đó là N2O
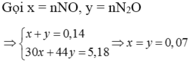
Hoặc có thể tính nNO và nN2O như sau:
do 37 = 30 + 44 2 ⇒ nNO = nN2O = 0,07
(Lưu ý: Khi = trung bình cộng thì số mol của 2 chất phải bằng nhau).
Đặt a = nAl, b = nMg ⇒ 27a + 24b = 8,862 (1)
Bảo toàn ne ⇒ 3nAl + 2nMg = 3nNO + 8nN2O ⇒ 3a + 2b = 0,77 (2)
Từ (1), (2) ⇒ a = 0,042; b = 0,322 ⇒ %mAl = 0 , 042 . 27 8 , 862 . 100 % = 12 , 8 % ⇒ Chọn B.

Đáp án B
Cho 5,52 gam Mg, Al tác dụng với 0,54 mol NaHSO4 và 0,08 mol HNO3 thu được dung dịch X chỉ chứa muối trng hòa và hỗn hợp Y gồm 3 khí không màu
Ta có: M Y ¯ = 15 , 75
do vậy Y có H2, N2 và N2O
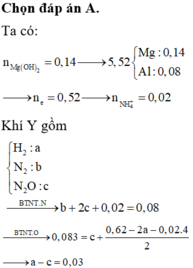
Cho NaOH dư vào X thu được kết tủa là Mg(OH)2
![]()
Do dung dịch X chứa chứa muối trung hòa nên H+ hết, mặt khác do sinh ra khí H2 nên NO3- hết.
Dung dịch X sẽ chứa Mg2+ 0,14 mol, Al3+ 0,08 mol, NH4+, Na+ 0,54 mol và SO42-0,54 mol.
Bảo toàn điện tích: ![]()
Bảo toàn N:
![]()
Gọi số mol N2, N2O và H2 lần lượt là a, b,c => a + b = 0,03
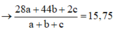
Bảo toàn e: 10a + 8b + 2c + 0,02.8 = 0,14.x + 0,08.3
Giải hệ: a=0,01; b=0,02; c=0,05
→ % H 2 = 7,94%


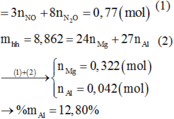



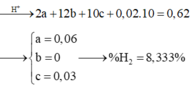
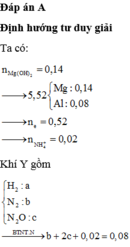
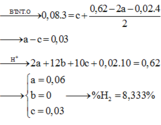

có j .đó thiếu thiếu
k có số mol của h2 khí .à
k có bạn