2 Hỗn hợp X gồm Al và 1 kim loại R. cho 1.93 gam X td với dung dịch H2SO4 loãng ( dư ), thu được 1.456 lít khí H2 (dktc). Nếu cho 1.93 gam X td hết với dung dịch HNO3 đặc, nóng (dư), thu được 3.36 lít khí NO2 (dktc). kim loại R là:
A Fe B Mg C Zn D Sn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

TH1: Hóa trị `M` đổi `->M:\ Fe`
`Fe^0->Fe^{+2}+2e`
`2H^{-1}+2e->H_2^0`
Bảo toàn electron: `n_{Fe}=n_{H_2}=0,14(mol)`
`->n_{Cu}={11,2-0,14.56}/{64}=0,0525(mol)`
`Cu^0->Cu^{+2}+2e`
`Fe^0->Fe^{+3}+3e`
`S^{+6}+2e->S^{+4}`
Bảo toàn electron: `2n_{Cu}+3n_{Fe}=2n_{SO_2}=0,525`
`->2.0,0525+3.0,14=0,525`
Nhận.
`->M` là Iron `(Fe).`
TH2: Hóa trị `M` không đổi.
`M` hóa trị `n`
Đặt `n_{Cu}=x(mol);n_M=y(mol)`
`M^0->M^{+n}+n.e`
`2H^{-1}+2e->H_2^0`
Bảo toàn electron: `ny=2n_{H_2}=0,28`
`->y={0,28}/n(mol)`
`M^0->M^{+n}+n.e`
`Cu^0->Cu^{+2}+2e`
`S^{+6}+2e->S^{+4}`
Bảo toàn electron: `2x+ny=2n_{SO_2}=0,525`
`->x={0,525-0,28}/2=0,1225(mol)`
`->m_M=11,2-0,1225.64=3,36(g)`
`->M_M={3,36}/{{0,28}/n}=12n`
`->n=2;M_M=24`
`->M` là magnesium `(Mg).`
Vậy `M` là `Mg` hoặc `Fe.`

Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n Cu = n SO 2 = 0 , 075 mol.
Đặt n Cr = x mol; n Fe = y mol → m X 52x + 56y + 0,075 × 64 = 18,2 gam.
x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
mCr trong X = 42,86% và %mCu trong X = 26,37%
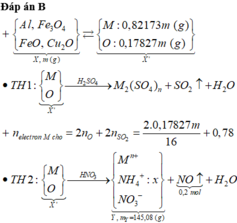
Đáp án A

Chọn đáp án A
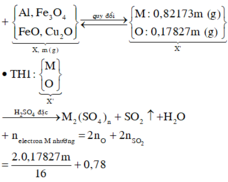
Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n C u = n S O 2 = 0 , 075 m o l
Đặt nCr = x mol; nFe = y mol ⇒ m X = 52x + 56y + 0,075 × 64 = 18,2 gam.
nH2 = x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
⇒ % mCr trong X = 42,86% và %mCu trong X = 26,37%

Định hướng tư duy giải

=> 145,08 = 0,82173m + 62.(0,0225.8+nO.2+0,2.3)+0,0225.80
=> m = 43,08.
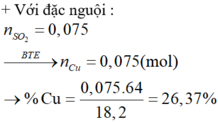


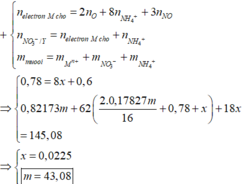
Gọi nAl=a; nR=b→ 27a+ Rb= 1,93.
(Từ số mol H2 → R có PƯ với H2SO4).
Al(0)→ Al(+3) +3 e
a_____a______3a
R(0)→ R(+x) +x e
b_____b______xb
R(0)→ R(+y) +y e
b_____b______yb
Giả thiết: nH2= 1,456/22,4= 0,065; nNO2= 3,36/22,4= 0,15
2H(+1) +2e→ H2
0,13___0,13__0,13
N(+5) +1e→ N(+4)
0,15___0,15__0,15
ÁDĐLBT e:
TN1: 3a+ xb= 0,13
TN2: 3a+ yb= 0,15
→ b= 0,02/(y-x) → y>x.
Xét các TH x=2; y=3 và x=1; y=2 ta có:
+ x=2; y=3→a=0,03; b=0,02 → R= 56 (Fe).
+ x=1; y=2→a=11/300; b=0.02→ R=47 ( loại)
Vậy chọn A.Fe