hoà tan 14,4 g một kim loại hoá trị II bằng hỗn hợp gồm 2 dung dịch HCl và H2SO4 loãng dư. Khí thu được cho qua bột CuO nóng màu đen. Sau khi phản ứng xảy ra hoàn toàn thu được 38,4 gam chất rắn màu đỏ. Xác định tên của kim loại
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


m rắn giảm = mO (oxit) => nO (oxit) = (1,6 – 1,408) : 16 = 0,012mol
Dễ thấy n = nO (oxit) = 0,012mol
=> nH2 ban đầu = 0,012 : 80% = 0,015
=> nFe = nH2= 0,015 → x = 0,015
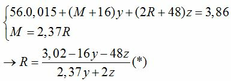
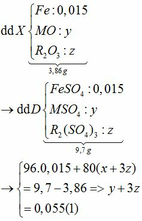
Ta có: CO + O(Oxit) → CO2
Vì: m(Rắn giảm) = mO(Oxit) → nO(Oxit) = (3,86 – 3,46) : 16 = 0,025
TH1: cả 2 oxit đều bị khử bởi CO
→ nO(Oxit) = y + 3z = 0,025 kết hợp với (1) loại
TH2: chỉ có MO bị khử bởi CO
→ nO(Oxit) = nMO = 0,025 → y = 0,025 kết hợp với (1) => z = 0,01
Kết hợp với (*) => M = 64 (Cu)
TH3: chỉ có R2O3 bị khử bởi CO
→ nO(Oxit) = 3.nR2O3 → z = 0,025/3 kết hợp với (1) => y = 0,03
Kết hợp với (*) y => M lẻ => loại
Vậy %m các chất trong X là: 21,76%; 51,81%; 26,43%

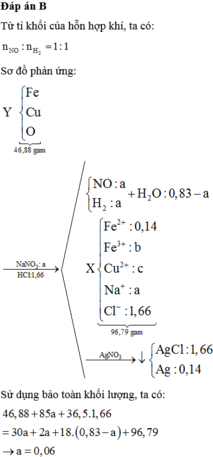
Đáp án D
Vì dung dịch D chỉ chứa một chất tan duy nhất và chất rắn G chỉ gồm một chất nên dung dịch D chứa NaAlO2 và G chứa CuO.
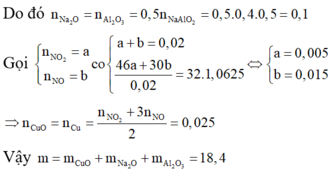

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
Phương trình hóa học của phản ứng:
Zn + S → ZnS
Fe + S → FeS
ZnS + H2SO4 → ZnSO4 + H2S
FeS + H2SO4 → H2S + FeSO4


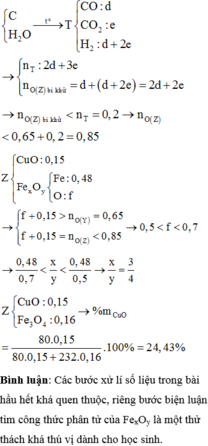
gọi kim loại cần tìm là R và nguyên tử khối của KL R là M
Ta có nR = 14,4/M(**)
PTHH :
R +2HCl -->RCl2 +H2(1)
R + H2SO4 --->RSO4 +H2(2)
H2 + CuO --> Cu + H20(3)
nCu=38,4/64=,6 mol
Theo pt(3) => nH2 =nCu= 0,6 mol
Theo PT (1) và (2) : nR =nH2 = 0,6 mol(*)
Từ (*) và (**) ta có 14,4/M =0,6
=> M =14,4/0,6 = 24(đvC)
Vậy kim loại cần tìm là Magie (Mg=24)