Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe} =a (mol) ; n_{Zn} = b(mol)\\ \Rightarrow 56a + 65b = 35,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Zn + 2HCl \to ZnCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{13,44}{22,4} = 0,6(2)\\ (1)(2) \Rightarrow a = 0,4 ; b = 0,2\\ m_{Fe} = 0,4.56 = 22,4(gam)\\ m_{Zn} = 0,2.65 = 13(gam)\)

\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: 56nFe + 65nZn = 35,4 (1)
Theo PT: \(n_{H_2}=n_{Fe}+n_{Zn}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,4\left(mol\right)\\n_{Zn}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,4.56=22,4\left(g\right)\\m_{Zn}=0,2.65=13\left(g\right)\end{matrix}\right.\)

\(n_{H_2}=\dfrac{12,32}{22,4}=0,55mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Gọi x, y lần lượt là số mol của Fe và Al:
\(\left\{{}\begin{matrix}56x+27y=13,7\\x+2y=0,55\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,2\end{matrix}\right.mol\)
\(\%m_{Fe}=\dfrac{0,15.56}{13,7}.100\%=61,31\%\)

Sửa 13,4 → 13,44
\(Gọi : n_{Fe} = a(mol) ; n_{Zn} = b(mol)\\ \Rightarrow 56a + 65b = 35,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Zn + 2HCl \to ZnCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{13,44}{22,4} = 0,6(2)\\ (1)(2) \Rightarrow a = 0,4 ; b = 0,2\\ m_{Fe}= 0,4.56 = 22,4(gam)\\ m_{Zn} = 0,2.65 = 13(gam)\)

Chọn B.
Ta có: n H 2 = 2 , 464 22 , 4 = 0 , 11 m o l
Chỉ có phenol và axit axetic mới phản ứng được với K nên:
C 6 H 5 O H C H 3 C O O H → + K 1 2 H 2
22 mol ← 0,11 mol
Khi cho X tác dụng với NaOH thì cả 3 chất đều tác dụng với NaOH theo tỉ lệ mol 1:1, nghĩa là:
n X = n N a O H = 0 , 3 m o l
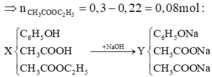
Theo sơ đồ trên ta thấy:
+ Đối với 2 chất đầu từ X đến Y chỉ thay 1 H bằng 1 Na nên khối lượng tăng: 22.0,22 gam.
+ Chất sau thay C2H5 bằng Na nên khối lượng giảm: (29 - 23).0,08 gam
=>mY - mX = 22.0,22 - (29 - 23).0,08 = 4,36 gam

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl -->ZnCl2 + H2
____0,2<----------------------0,2
=> mZn = 0,2.65 = 13 (g)
mCu = mrắn không tan = 19,5 (g)
\(\left\{{}\begin{matrix}\%Zn=\dfrac{13}{13+19,5}.100\%=40\%\\\%Cu=\dfrac{19,5}{13+19,5}.100\%=60\%\end{matrix}\right.\)
`n_(H_2)=4,48/22,4=0,2 (mol)`
Ta có PTHH: `Zn+2HCl --> ZnCl_2 +H_2`
Theo PT: `1`--------------------------------`1`
Theo đề: `0,2`------------------------------`0,2`
`m_(Zn)=0,2.65=13(g)`
Vì `Cu` không phản ứng với `HCl` nên `m_(chất rắn không tan)=m_(Cu)=19,5(gam)`
`%Zn=13/(13+19,5) .100%=40%`
`%Cu=100%-40%=60%`





\(n_{H_2}=\frac{6,048}{22,4}=0,27mol\)
Đặt \(\hept{\begin{cases}x\left(mol\right)=n_{Fe}\\y\left(mol\right)=n_{Zn}\end{cases}}\)
\(\rightarrow56x+65y=16,47\left(1\right)\)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Theo phương trình \(n_{Fe}+n_{Zn}=n_{H_2}\)
\(\rightarrow x+y=0,27\left(2\right)\)
Từ (1) và (2) => x = 0,12 và y = 0,15
\(\rightarrow m_{Zn}=0,15.65=9,75g\)
\(n_{H_2}=\frac{6,048}{22,4}=0,27mol\)
Đặt\(\hept{\begin{cases}x\left(mol\right)=n_{Fe}\\y\left(mol\right)=n_{Zn}\end{cases}}\)
\(\rightarrow56x+65y=16,47\left(1\right)\)
Phương trình hóa học:\(Fe+2HCL\rightarrow FeCl_2+H_2\uparrow\)
\(Zn+2HCL\rightarrow ZnCl_2+H_2\uparrow\)
Theo phương trình:\(n_{Fe}+n_{Zn}=n_{H_2}\)
\(\rightarrow x+y=0,27\left(2\right)\Rightarrow\hept{\begin{cases}x=0,12\\y=0,15\end{cases}}\)
\(\rightarrow m_{Zn}=0,15\cdot65=9,75g\)