Từ 120kg FeS2 có thể sản xuất đc bao nhiêu kg axit H2SO4 98%? Biết hiệu suất của cả quá trình là 80%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đổi 1,2 tấn = 1200 kg
Ta có: \(n_{FeS_2}=\dfrac{1200}{120}=10\left(kmol\right)\)
Bảo toàn Lưu huỳnh: \(n_{H_2SO_4\left(lý.thuyết\right)}=2n_{FeS_2}=20\left(kmol\right)\)
\(\Rightarrow m_{ddH_2SO_4\left(thực\right)}=\dfrac{20\cdot98}{50\%}\cdot80\%=3136\left(kg\right)=3,136\left(tấn\right)\)

Đáp án C.
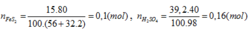
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%

ôi t làm nhầm....kq là
3,8 tấn ( cân bằng thêm 2 vào h2so4 là okok)
FeS2 ==> H2SO4
120g 98g
2,85( vì 5% tạp chất) 2,3275 (tấn)
vì H=80% ====> m H2SO4=1,3965( tấn). nhưng có C% H2SO4= 98%
VẬY mdd H2S04 là 1,425 tấn

nFeS2 = \(\dfrac{120000}{120}\) = 1000mol
2FeS2 + 2H2O + 7O2 \(^{to}\rightarrow\) 2FeSO4+ 2H2SO4
1000---------------------------------------->1000
=>mH2SO4(dung dịch) = 1000 . 1,84 = 1840 g
=>nH2SO4 = \(\dfrac{1840.98}{100.98}\) = 18,4 mol
=>mH2SO4 = 18,4 . 98 = 1803,2 g = 1,8032 kg
mà H = 80%
=> mH2SO4(thực tế) = 1,8032 . \(\dfrac{80}{100}\) = 1,44256 kg


$n_{FeS_2} = \dfrac{120}{120} = 1(kmol)$
$n_{FeS_2\ pư} = 1.80\% = 0,8(kmol)$
Bảo toàn nguyên tố với S :
$n_{H_2SO_4} = 2n_{FeS_2\ pư} = 1,6(kmol)$
$m_{dd\ H_2SO_4} = \dfrac{1,6.98}{98\%} = 160(kg)$
hnamyuh \(n_{FeS_2}pư\) thay chữ phản ứng thành chữ thực tế cũng được đúng không ạnh