Một hỗn hợp A có khối lượng là 19,1g gồm 2 muối cacbonat của 2 kim loại kìm thuộc 2 chu kì kế tiếp nhau trong bảng hệ thống tuần hoàn. Hòa tan hết A trong dung dịch HCl thu được khí B. Hấp thụ hoàn toàn khí B trong 700ml dung dịch Ba(OH)2 0,5M thu được 29,55g kết tủa
a) Xác định công thức của 2 muối cacbonat
b) Tính thành phần phần trăm theo khối lượng của mỗi muối trong hỗn hợp A

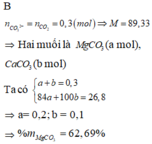





Gọi CT dạng chung của 2 muối cacbonat là \(M_2CO3\)
\(M2CO3+2HCl\rightarrow2MCl+H2O+CO2\)
Ta có: \(n_{Ba\left(OH\right)2}=0,7.0,5=0,35\left(mol\right)\)
\(n_{BaCO3}=\dfrac{29,55}{ }=0,15\left(mol\right)\)
=>TH1: Ba(OH)2 dư=> tạo 1 muối trung hoà
\(CO2+Ba\left(OH\right)2\rightarrow BaCO3+H2O\)
\(n_{CO2}=n_{BaCO3}=0,15\left(mol\right)\)
\(n_{M2CO3}=n_{CO2}=0,15\left(mol\right)\)
\(M_{M2CO3}=\dfrac{19,1}{0,15}=127,3\)
\(\Rightarrow M_M=\dfrac{127,3-12-16.3}{2}=33,65\)
=> 2 muối cacbonat là \(Na2CO3\) và K2CO3
Gọi \(n_{Na2CO3}=a\left(mol\right),n_{K2CO3}=b\left(mol\right)\)
khi đó:
\(\left\{{}\begin{matrix}106a+138b=19,1\\a+b=0,15\left(theo-CO2\right)\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,05\\b=0,1\end{matrix}\right.\)
\(\%m_{Na2CO3}=\dfrac{0,05.106}{19,1}.100\%=27,75\%\)
\(\%m_{K2CO3}=100-27,75=72.25\%\)
TH2: CO2 dư=>tạo 2 muối
\(CO2+Ba\left(OH\right)2\rightarrow BaCO3+H2O\)
0,15<---0,15<-----------0,15(mol)
\(\Rightarrow n_{Ba\left(OH\right)2}\)còn lại\(=0,25-0,15=0,2\left(mol\right)\)
\(2CO2+Ba\left(OH\right)2\rightarrow Ba\left(HCO3\right)2\)
0,4<-------0,2(mol)
\(\Rightarrow n_{M2CO3}=n_{CO2}=0,4\left(mol\right)\)
\(M_{M2CO3}=\dfrac{19,1}{0,4}=47,45\)
\(\Rightarrow M_M=\dfrac{47,45-12-16.3}{2}=-6,125\)
=> LOẠI
Chúc bạn học tốt^^
Cảm ơn câu trả lời và lời động viên của bạn nha!!!!