Các bạn chỉ mình khi có 2 PTHH CuO +H2 _>Cu+ H2o Fe2o3 + 3H2 -> 2Fe +3H2O **** Khi mà có khối lượng hỗn hợp Cu và Fe là 28 chẳng hạn thì tính số mol của hai hỗn hợp Cu và Fe này là lấy khối lượng của hai hỗ hợp rồi chia khối lượng Mol của Fe cộng với khối lượng Mol của Cu là ra số mol của hỗn hợp đúng không ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đặt \(\left\{{}\begin{matrix}n_{Cu}=x\\n_{Fe}=y\end{matrix}\right.\) ( mol ) \(\Rightarrow n_{hh}=64x+56y=26,4\left(g\right)\) (1)
mà \(64x=1,2.56y\) (2)
\(\left(1\right);\left(2\right)\Rightarrow\left\{{}\begin{matrix}x=0,225\\y=\dfrac{3}{14}\end{matrix}\right.\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,225 0,225 ( mol )
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
\(\dfrac{9}{28}\) \(\dfrac{3}{14}\) ( mol )
\(V_{H_2}=22,4.\left(0,225+\dfrac{9}{28}\right)=12,24\left(l\right)\)

gọi nFe2O3=a(mol) nCuO=b(mol) Sau khi cho qua H2 dư=> nFe=2a n Cu=b
Áp dụng bảo toàn e: nSO2=(6a+2b)/2=3a+b(mol)
m tăng= 56. 2a+ 64b-(3a+b)32=7,2 (1)
m hh ban đầu= 160a + 80b= 24(2)
Từ (1) và (2) ta được a=0,05 b=0,2
=> mFe =2,8(g) mCu=12,8(g)

Đáp án : D
mCO2 = 1,63mH2O => 1,5nCO2 = nH2O
Bảo toàn nguyên tố : nC : nH = 1 : 3
Mà nH ≤ 2nC + 2 => X và Y là C2H6Ox và C2H6Oy
=> X,Y đều no. Phản ứng được với Na tạo H2
=> X và Y là C2H5OH và C2H4(OH)2
=> nCu(OH)2 = ½ netylen glicol => netylen glicol = 0,2 mol
=> nancol etylic = 0,3 mol => %n 2 chất là 40% và 60%

Đáp án B
Các hỗn hợp tan hoàn toàn là a, b, c, c, d. Các muối tan thì nó tan trong HCl, FeS và Al đều phản ứng với HCl. Cu tan trong hỗn hợp b do NO3- và H+ đều dư để hoàn tan Cu. 1 mol Fe2O3 tan tạo 2 mol Fe3+ và nó đủ hoà tan 1 mol Cu. e không tan hết vì Cu không tác dụng với H+ và nó cũng không phản ứng với ion của chính nó.

Đáp án B
Các hỗn hợp tan hoàn toàn là a, b, c, c, d. Các muối tan thì nó tan trong HCl, FeS và Al đều phản ứng với HCl. Cu tan trong hỗn hợp b do NO3- và H+ đều dư để hoàn tan Cu. 1 mol Fe2O3 tan tạo 2 mol Fe3+ và nó đủ hoà tan 1 mol Cu. e không tan hết vì Cu không tác dụng với H+ và nó cũng không phản ứng với ion của chính nó

\(Tacó:m_{Fe_2O_3}:m_{CuO}=3:2\\ m_{Fe_2O_3}+m_{CuO}=40\\ \Rightarrow m_{Fe_2O_3}=24\left(g\right)\Rightarrow n_{Fe_2O_3}=0,15\left(mol\right)\\ \Rightarrow m_{CuO}=16\left(g\right)\Rightarrow n_{CuO}=0,2\left(mol\right)\\ Fe_2O_3+3H_2-^{t^o}\rightarrow2Fe+3H_2O\left(1\right)\\ CuO+H_2O-^{t^o}\rightarrow Cu+H_2O\left(2\right)\\TheoPT\left(1\right): n_{Fe}=2n_{Fe_2O_3}=0,3\left(mol\right)\\ \Rightarrow m_{Fe}=16,8\left(g\right)\\TheoPT\left(2\right): n_{Cu}=n_{CuO}=0,2\left(mol\right)\\ \Rightarrow m_{Cu}=0,2.64=12,8\left(g\right)\)

\(m_{CO_2}=17,6g\Rightarrow n_{CO_2}=0,4\left(mol\right)\)
⇒nO trong hỗn hợp=0,4 mol
\(đặtn_{Fe_2O_3}=a;n_{CuO}=b\)
\(\Rightarrow\left\{{}\begin{matrix}160a+80b=24\\3a+b=0,4\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,2\\n_{Cu}=0,1\end{matrix}\right.\)

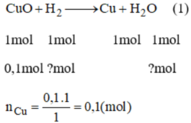
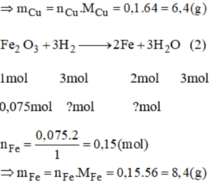
Không được em nhé !
Tại sao không được vậy ạ