hòa tan hoàn toàn 13,45g hỗn hợp X gồm Al, Fe, Cu trong dung dịch H2SO4 0,5M loãng, dư thì thu được 5,6l khí bay ra ở ĐKTC và còn lại 8g phần rắn Y không tan.
A/ tính phần trăm khối lượng mỗi chất ban đầu
B/ tính thể tích dung dịch H2SO4 tham gia phản ứng


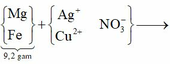
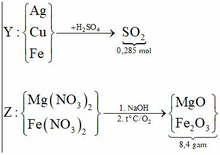

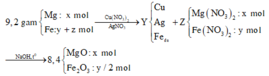
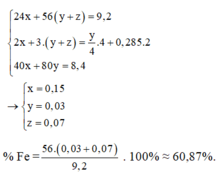
a) Y là Cu
$m_{Cu} = 8(gam)$
Gọi $n_{Al} = a(mol) ; n_{Fe} = b(mol)$
Ta có : $27a + 56b + 8 = 13,45(1)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{H_2} = 1,5a + b = \dfrac{5,6}{22,4} = 0,25(2)$
Từ (1)(2) suy ra a = 0,15 ; b = 0,025$
$\%m_{Cu} = \dfrac{8}{13,45}.100\% = 59,47\%$
$\%m_{Al} = \dfrac{0,15.27}{13,45}.100\% = 30,11\%$
$\%m_{Fe} = 10,42\%$
b)
$n_{H_2SO_4} = n_{H_2} = 0,25(mol)$
$V_{dd\ H_2SO_4} = \dfrac{0,25}{0,5} = 0,5(lít)$