Đổi: 0,06 m\(^3\) = .......... lít
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Hỗn hợp A gồm 0,56 g Fe và 16 g Fe2O3.Trộn A với m gam bột nhôm rồi nungở nhiệt độ cao (không có không khí), thu được hỗn hợp D. Nếu cho D tan trong dung dịch H2SO4loãng dư thì thu được a lít khí, nhưng cho D tác dụng với dung dịch NaOH (dư) thì thể tích khí thu được là 0,25a lít (trong cùng điều kiện). Khoảng giá trị của m là
A. 0,54 < m < 2,70. B. 2,7 < m < 5,4.
C. 0,06 < m < 6,66. D. 0,06 < m < 5,4.
nFe = 0.01
nFe2O3 = 0.1
Gọi hiệu suất pứ nhiệt nhôm là h ( 0 < h < 1 )
h = 0
=> Al chưa pứ
nH2 do Fe sinh ra = (a - 0.25a)/22.4 = 0.01
=> a = 112/375
nH2 do Al sinh ra = 0.25a/22.4
=> nAl = 5a/672 => m = 0.06
h =1 :
Al dư,Fe2O3 hết
nAl pứ = 2nFe2O3 = 0.2
=> nFe = 0.1*2 + 0.01 = 0.21
nH2 do fe sinh ra = (a - 0.25a)/22.4 = 0.21
=> a = 6.272
nH2 do Al sinh ra = 0.25a/22.4
=> nAl = 5a/672 => nAl ban dầu = 5a/672 + 0.2 = 0.74/3
=> m = 6.66g
=> C 0,06 < m < 6,66

Đáp án C.
a mol AlCl3 + 1 lit dd NaOH b M à 0,05 mol kết tủa Al(OH)3 (1)
Thêm tiếp 1 lit dd NaOH trên à 0,06 mol kết tủa (2)
Chứng tỏ ở thí nghiệm (1) AlCl3 chưa tác dụng hết, NaOH tác dụng hết.
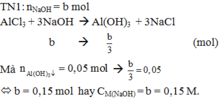

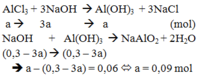

\(0,06\left(31\right)=0,06+0,00\left(31\right)=0,06+\frac{1}{100}.0,\left(31\right)=0,06+\frac{1}{100}.31.0,\left(01\right)=0,06+\frac{31}{100}.\frac{1}{99}=0,06+\frac{31}{9900}=\frac{25}{396}\)
0,06(31)=0,06+0,00(31)=0,06+0,00(01).31=3/50+31/9900=25/396
vậy 0,06(31)=25/396

120 mV = 0,12 V; 2,5 kV = 2 500 V; 0,06 kV = 60 V;
0,008 kV = 8 V; 5000 mV = 5 V; 0,0009 kV = 0,9 V;
900 mV = 0,9 V; 0,0012 kV = 1,2 V; 500 mV = 0,5 V

Đáp án C
Trường hợp 1: Thí nghiệm ban đầu chưa có phản ứng hòa tan một phần kết tủa
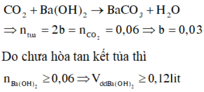
Trường hợp 2: Thí nghiệm ban đầu đã có phản ứng hòa tan hoàn toàn kết tủa
Áp dụng công thức giải nhanh
Thí nghiệm 1 có 2b = 0,5V - 0,06
Thí nghiệm 2 có b = 0,5V - 0,08
![]()




0,06 m3 = 60 dm3 = 60 lít
\(0,06m^3=60dm^3=60\) lít
Chúc bạn học tốt !!!