Khối lượng nước (ở trạng thái lỏng) sẽ thu được khi đốt cháy hoàn toàn 1,12 lít khí hiđro (đktc) với khí oxi là (H = 1; O = 16)
Mn giúp em vs ạ em cảm ơn \(@^0^@)/
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



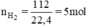
Phương trình phản ứng tổng hợp nước:
2H2 + O2 → 2H2O.
Theo pt: nH2O = nH2 = 5mol.
mH2O= 5.18 = 90g.
Khối lượng riêng của nước là 1g/ml thể tích nước lỏng thu được là 90ml.

\(n_{H_2}=\dfrac{112}{22,4}=5\left(mol\right)\)
Bảo toàn nguyên tố H : \(n_{H_2}.2=n_{H_2O}.2\)
=> nH2O =5(mol)
=> m H2O = 5.18= 90(g)

\(a) 2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ n_{H_2O} = \dfrac{1,8}{18} = 0,1(mol)\\ n_{H_2} = n_{H_2O} = 0,1 \Rightarrow V_{H_2} = 0,1.22,4 = 2,24(lít)\\ V_{O_2} = \dfrac{1}{2}V_{H_2} = 1,12(lít)\\ b) n_{H_2O} = n_{H_2} = \dfrac{112}{22,4} = 5(mol)\\ \Rightarrow m_{H_2O} = 5.18 = 90(gam)\)

a)
SO3 + H2O $\to$ H2SO4
n H2SO4 = n SO3 = 240/80 = 3(mol)
m H2SO4 = 3.98 = 294(gam)
b)
2H2 + O2 $\xrightarrow{t^o}$ 2H2O
V H2 / 2 = 0,56 < V O2 = 1,68 nên O2 dư
n H2O = n H2 = 1,12/22,4 = 0,05(mol)
m H2O = 0,05.18 = 0,9(gam)
V H2O = m/D = 0,9/1 = 0,9(ml)
c)
n NaOH = 16/40 = 0,4(mol)
Na2O + H2O $\to$ 2NaOH
n Na2O = 1/2 n NaOH = 0,2(mol)
m Na2O = 0,2.62 = 12,4(gam)
a)Ta có PT:SO4+H2O=H2SO4
Theo bài ra t có nSO4=240:96=2,5
Mà nSo4=nH2So4=2,5 mol
suy ra:mH2So4=2,5.98=245g

\(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\\
pthh:2H_2O\underrightarrow{\text{đ}p}2H_2+O_2\)
0,2 0,2 0,1
=> \(\left\{{}\begin{matrix}V_{H_2}=0,2.22,4=4,48\left(L\right)\\V_{O_2}=0,1.22,4=2,24\left(L\right)\end{matrix}\right.\)