Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) $Mg + H_2SO_4 \to MgSO_4 + H_2$
b)
Theo PTHH : $n_{Mg} = n_{MgSO_4} = n_{H_2SO_4} = 0,14.1,2 = 0,168(mol)$
$m_{Mg} = 0,168.24 = 4,032(gam)$
$m_{MgSO_4} = 0,168.120 = 20,16(gam)$
c)
$n_{H_2} = n_{H_2SO_4} = 0,168(mol)$
$V_{H_2} = 0,168.22,4=3,7632(lít)$

a, PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b, \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Fe}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c, \(n_{H_2SO_4}=n_{Fe}=0,1\left(mol\right)\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)

a)
\(Zn + 2HCl \to ZnCl_2 + H_2\)
b),c)
Theo PTHH :
\(n_{ZnCl_2} = n_{H_2} = n_{Zn} = \dfrac{13}{65} = 0,2(mol)\)
Vậy :
\(m_{ZnCl_2} = 0,2.136 = 27,2(gam)\\ V_{H_2} =0,2.22,4 = 4,48(lít)\)

a. Zn + 2HCl → ZnCl2 + H2
b. nZn = n\(_{ZnCl_2}\) =\(\dfrac{13}{65}=0,2\left(mol\right)\) => m\(_{ZnCl_2}\)= 0,2.136 = 27,2(g)
c. n\(_{H_2}\)= nZn = 0,2 (mol) => V\(_{H_2}\)=0,2.22,4 = 4,48 (lít)

a + b)
\(n_{Fe_3O_2}=\dfrac{m_{Fe_3O_2}}{M_{Fe_3O_2}}=\dfrac{9,6}{200}=0,048\left(mol\right)\)
Gọi kim loại thu được là A
PTHH: \(Fe_3O_2+H_2\rightarrow A+H_2O\)
Theo PT: 1mol __1mol__1mol_1 mol
Theo đề: 0,048 mol_0,048 mol_0,048 mol_0,048 mol
\(n_{H_2}=\dfrac{n_{Fe_3O_2}.1}{1}=0,048\left(mol\right)\)
\(V_{H_2}=n_{H_2}.22,4=0,048.22,4=1,0752\left(l\right)\)

\(n_{HCl}=\dfrac{18,25}{36,5}=0,5mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,25 0,5 0,5 ( mol )
\(m_{Fe}=0,25.56=14g\)
\(V_{H_2}=0,5.22,4=11,2l\)
\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
0,5 0,5 ( mol )
\(m_{H_2O}=0,5.18=9g\)

\(a.PTHH:Mg+2HCl\rightarrow MgCl_2+H_2\)
\(b.n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
Từ PTHH trên ta có:
1 mol Mg tác dụng với 2 mol HCl sinh ra 1 mol MgCl2 và 1 mol H2
=> 0,1 mol Mg tác dụng với 0,2 mol HCl sinh ra 0,1 mol MgCl2 và 0,1 mol H2
\(\Rightarrow m_{HCl}=36,5.0,2=7,3\left(g\right)\)
\(c.\Rightarrow m_{H_2}=0,1.2=0,2\left(g\right)\\ \Rightarrow V_{H_2\left(đktc\right)}=0,1.22,4=2,24\left(l\right)\)
\(d.C_1:\\ Áp.dụng.ĐLBTKL,ta.có:\\ m_{Mg}+m_{HCl}=m_{MgCl_2}+m_{H_2}\\ \Rightarrow m_{MgCl_2}=m_{Mg}+m_{HCl}-m_{H_2}=2,4+7,3-0,2=9,5\left(g\right)\)
\(C_2:Từ.PTHH.trên.ta.có:\\ n_{MgCl_2}=0,1\left(mol\right)\\ \Rightarrow m_{MgCl_2}=0,1.95=9,5\left(g\right)\)

\(n_{Fe}=\dfrac{28}{56}=0,5mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,5 1 0,5
\(V_{H_2}=0,5\cdot22,4=11,2l\)
\(m_{HCl}=1\cdot36,5=36,5g\)

a, PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b, Ta có: \(n_{Fe}=\dfrac{19,6}{56}=0,35\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Fe}=0,35\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,35.22,4=7,84\left(l\right)\)
c, Ta có: \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,15}{1}< \dfrac{0,35}{1}\), ta được H2 dư.
Theo PT: \(n_{H_2\left(pư\right)}=n_{CuO}=0,15\left(mol\right)\)
\(\Rightarrow n_{H_2\left(dư\right)}=0,35-0,15=0,2\left(mol\right)\)
\(\Rightarrow m_{H_2\left(dư\right)}=0,2.2=0,4\left(g\right)\)
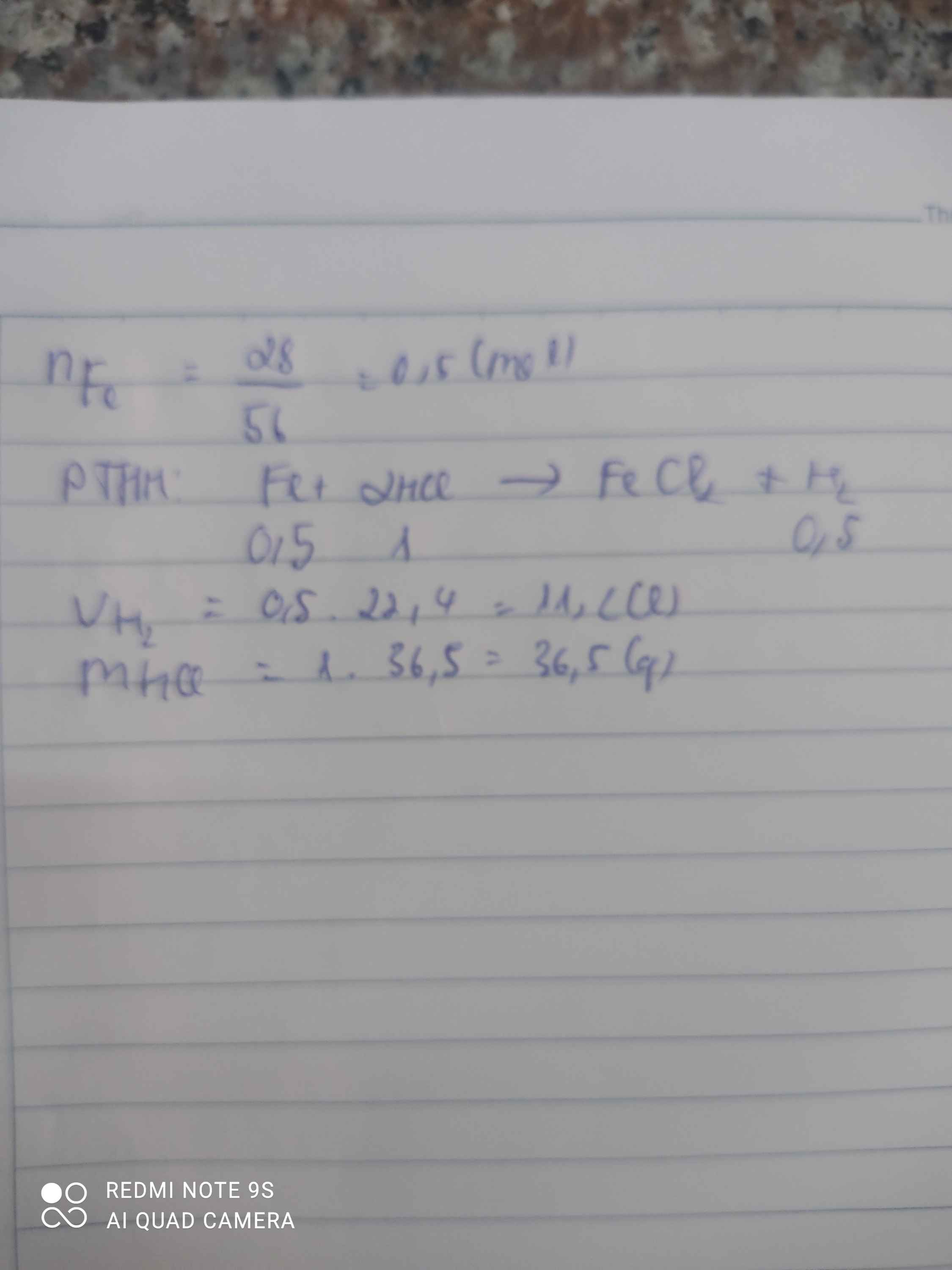
Ta có PTHH : Fe +2 HCl -> FeCl2 + H2
nHCl = 100* 14,6 / 100* 36,5 = 0,4 mol
Từ PTHH : nH2= 1/2 nHCl = 0,2 mol
-> VH2 = 0,2 * 22,4 = 4,48 l
nFe = 1/2 nHCl = 0,2 mol
mFe = o,2 * 56 = 11,2 g
Fe + 2HCl --> FeCl2 + H2
mFe= C% . mdd : 100 = 14,6 . 100 : 100 = 14,6 g