Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(n_{HCl}=0,2.0,1=0,02\left(mol\right)=n_{H^+}=n_{Cl^-}\)
\(n_{H_2SO_4}=0,2.0,15=0,03\left(mol\right)=n_{SO_4^{2-}}\) \(\Rightarrow n_{H^+}=2n_{H_2SO_4}=0,06\left(mol\right)\)
\(\Rightarrow\Sigma n_{H^+}=0,02+0,06=0,08\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,3.0,05=0,015\left(mol\right)=n_{Ba^{2+}}\)
\(\Rightarrow n_{OH^-}=2n_{Ba\left(OH\right)_2}=0,03\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,03___0,03 (mol) ⇒ nH+ dư = 0,05 (mol)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
0,015___0,015______0,015 (mol) ⇒ nSO42- dư = 0,015 (mol)
⇒ m = mBaSO4 = 0,015.233 = 3,495 (g)
\(\left[Cl^-\right]=\dfrac{0,02}{0,2+0,3}=0,04\left(M\right)\)
\(\left[H^+\right]=\dfrac{0,05}{0,2+0,3}=0,1\left(M\right)\)
\(\left[SO_4^{2-}\right]=\dfrac{0,015}{0,2+0,3}=0,03\left(M\right)\)
b, pH = -log[H+] = 1

a)
nHCl=nH+=0,8.0,1=0,08 mol
nOH-=2.nCa(OH)2=2.0,15.0,1=0,12 mol
Khi trộn HCl với Ca(OH)2 xảy ra phản ứng trung hòa:
H+ + OH- ------H2O
0,08-----0,12
=>OH- dư
nOH- dư=0,12-0,08=0,04 mol
Vdung dịch sau pư=0,1+0,4=0,5 (l)
=> [OH- ]=0,04/0,5=0,8M
b) Dd D chứa 0,04 mol OH- dư (câu a)
Gọi thể tích H2SO4 Cần tìm là V (l)
=>nH+=2nH2SO4=2.1.v=2V (mol)
Khi cho H2SO4 vào D thì tiếp tục xảy ra pư trung hòa
H+ + OH- -------> H2O
2V -----0,04
vì phản ứng vừa đủ (đề cho)
=> mol H+=mol OH-
<=>2V=0,04<=>V=0,02 l

Chọn C
pH = 11 → [ OH - ] = 10 - 3 (M)
pH = 12 → [ OH - ] = 10 - 2 (M)
Tổng số mol OH - có trong dung dịch X là: n = 0 , 1 . 10 - 3 + 0 , 05 . 10 - 2 = 6 . 10 - 4 (mol)
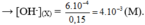

\(n_{HCl}=Cm.V=1.0,1=1mol\)
\(n_{H_2SO_4}=Cm.V=0,5.0,1=0,05mol\)
Thể thích của dd D là 200ml = 0,2l
\([H^+]=\frac{n_{HCl}+2.n_{H_2SO_4}}{V}=\frac{0,1+0,1}{0,2}=1M\)
\([Cl^-]=\frac{n_{HCl}}{V}=\frac{0,1}{0,2}=0,5M\)
\([SO_4^{2-}]=\frac{n_{H_2SO_4}}{V}=\frac{0,05}{0,2}=0,25M\)
Khi cho dd D vào \(Ba\left(OH\right)_2\) chỉ có \(H_2SO_4\) tác dụng, tạo kết tủa
\(H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+2H_2O\)
\(0,05....\rightarrow0,05mol\)
\(\rightarrow m_{BaSO_4}=n.M=0,05.233=11,65g\)

\(n_{Ba\left(OH\right)_2}=0,3.0,1=0,03\left(mol\right)\\ n_{HCl}=0,2.0,15=0,03\left(mol\right)\\ Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H_2O\\ Vì:\dfrac{n_{Ba\left(OH\right)_2\left(đề\right)}}{n_{Ba\left(OH\right)_2\left(PTHH\right)}}=\dfrac{0,03}{1}>\dfrac{n_{HCl\left(đề\right)}}{n_{HCl\left(PTHH\right)}}=\dfrac{0,03}{2}\\ \Rightarrow Ba\left(OH\right)_2dư\\ n_{Ba\left(OH\right)_2\left(p.ứ\right)}=\dfrac{n_{HCl}}{2}=\dfrac{0,03}{2}=0,015\\ n_{Ba\left(OH\right)_2\left(dư\right)}=0,03-0,015=0,015\left(mol\right)\\ \left[OH^-\right]=2.\left[Ba\left(OH\right)_2\left(dư\right)\right]=\dfrac{0,015}{0,3+0,2}=0,03\left(M\right)\\ \Rightarrow pH=14+log\left[OH^-\right]=14+log\left[0,03\right]\approx12,477\)
Nồng độ mol/lít các ion trong dd A:
\(\left[OH^-\left(dư\right)\right]=0,06\left(M\right)\left(nt\right)\\\left[Cl^-\right]=2.\left[BaCl_2\right]=2.\left(\dfrac{0,015}{0,5}\right)=0,06\left(M\right)\\ \left[Ba^{2+}\right]=0,03+ 0,03=0,06\left(M\right)\)
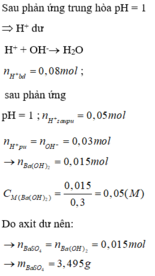
\(n_{NaOH}=0,15.0,6=0,09\left(mol\right)\\ n_{H_2SO_4}=0,05.0,15=0,0075\left(mol\right)\\ 2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\\ Vì:\dfrac{0,09}{2}>\dfrac{0,0075}{2}\Rightarrow NaOHdư\\ n_{NaOH\left(dư\right)}=0,09-2.0,0075=0,075\left(mol\right)\\ \left[OH^-\right]=\left[NaOH\right]=\dfrac{0,075}{0,15+0,05}=0,375\left(M\right)\\ \Rightarrow C\)