Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, 2H2O ---đp---> 2H2 + O2
4P + 5O2 ---to---> 2P2O5
P2O5 + 3H2O ---> 2H3PO4
b, 4FeS2 + 11O2 ---to---> 2Fe2O3 + 8SO2
Fe2O3 + 3H2 ---to---> 2Fe + 3H2O
c, 2NaCl ---đpnc---> 2Na + Cl2
H2 + Cl2 ---as---> 2HCl
d, 2HCl + Fe ---> FeCl2 + H2
e, 6Na + 2H3PO4 ---> 2Na3PO4 + 3H2

- Sắt từ oxit (Fe3O4)
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
- Axit Photphoric (H3PO4)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
- Canxi hidroxit (Ca(OH)2)
\(Ca+2H_2O\rightarrow Ca\left(OH\right)_2+H_2\)

2H2O-đp->2H2+O2
2NaCl-dpnc->2Na+Cl2
2NaCl+2H2O-đpcó mn>2NaOH+H2+Cl2
H2+Cl2-as-2HCl
2FeS2+11\2O2-to>Fe2O3+4SO2
Fe2O3+6Hcl->2Fecl3+3H2O
FeCl3+3NaOH->Fe(OH)3+3NaCl

\(m_{FeS_2}=0.6\left(tấn\right)=0.6\cdot10^3\left(kg\right)\)
\(n_{FeS_2}=\dfrac{0.6\cdot10^3}{120}=\dfrac{10^3}{200}\left(kmol\right)\)
Dựa vào sơ đồ phản ứng :
\(n_{H_2SO_4}=2n_{FeS_2}=2\cdot\dfrac{10^3}{200}=\dfrac{10^3}{100}=10\left(kmol\right)\)
\(m_{H_2SO_4\left(tt\right)}=10\cdot\dfrac{98}{80\%}=1225\left(kg\right)\)
\(m_{dd_{H_2SO_4}}=\dfrac{1225}{98\%}=1250\left(kg\right)=12.5\left(tấn\right)\)
\(m_{FeS_2}=\dfrac{1.60}{100}=0,6\left(tấn\right)\)
=> \(m_{FeS_2\left(pư\right)}=\dfrac{0,6.80}{100}=0,48\left(tấn\right)\)
Cứ 1 mol FeS2 điều chế được 2 mol H2SO4
=> 120g FeS2 điều chế được 196g H2SO4
=> 0,48 tấn FeS2 điều chế được 0,784 tấn H2SO4
=> \(m_{ddH_2SO_4}=\dfrac{0,784.100}{98}=0,8\left(tấn\right)\)

a)
\(4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 4SO_2\\ 2SO_2 + O_2 \xrightarrow{t^o,V_2O_5} 2SO_3\\ SO_3 + H_2O \to H_2SO_4\)
b)
\(m_{FeS_2} = 1000.60\% = 600(kg)\\ n_{FeS_2} = \dfrac{600}{120} = 5(kmol)\\ \Rightarrow n_{FeS_2\ pư} = 5.80\% = 4(kmol)\)
Bảo toàn nguyên tố với S : \(n_{H_2SO_4} = 2n_{FeS_2} = 4.2 = 8(kmol)\)
Suy ra :
\(m_{H_2SO_4} = 8.98 = 784(kg)\\ \Rightarrow m_{dd\ H_2SO_4} = \dfrac{784}{98\%} =800(kg)\)

- Hiện tượng vật lý: nghiền nhỏ quặng pirit sắt ( F e S 2 )
- Hiện tượng hóa học:
+Quặng pirit sắt cháy tạo thành F e 2 O 3 và S O 2
+Oxi hóa S O 2 thành S O 3
+Hợp chất nước và S O 3 tạo thành axit sunfuric ( H 2 S O 4 )

m FeS2 = 0,9 tấn = 900 kg
4 FeS2 + 11 O2 -> 2 Fe2O3 + 8 SO2
2 SO2 + O2 -> 2 SO3
SO3 + H2O -> H2SO4
ta có 120 g FeS2 điều chế được 196 g H2SO4
=> 900 kg FeS2 điều chế được 1470 kg H2SO4
do H = 80% (Nếu là hiệu suất phản ứng ta phải tính hiệu suất điều chế = 80%. 80% . 80% = 51,2 %)
nên thực thế chỉ thu được 1470 . 80% = 1176 (kg) H2SO4
m dd H2SO4 = 1176 : 98% = 1200 (kg) = 1 200000 g
V dd H2SO4 = 1 200 000 : 1,84 = 652173 ml = 652 l
bạn ơi cho mình hỏi ta có 120 g FeS2 điều chế được 196 g H2SO4 ở đâu ra vậy
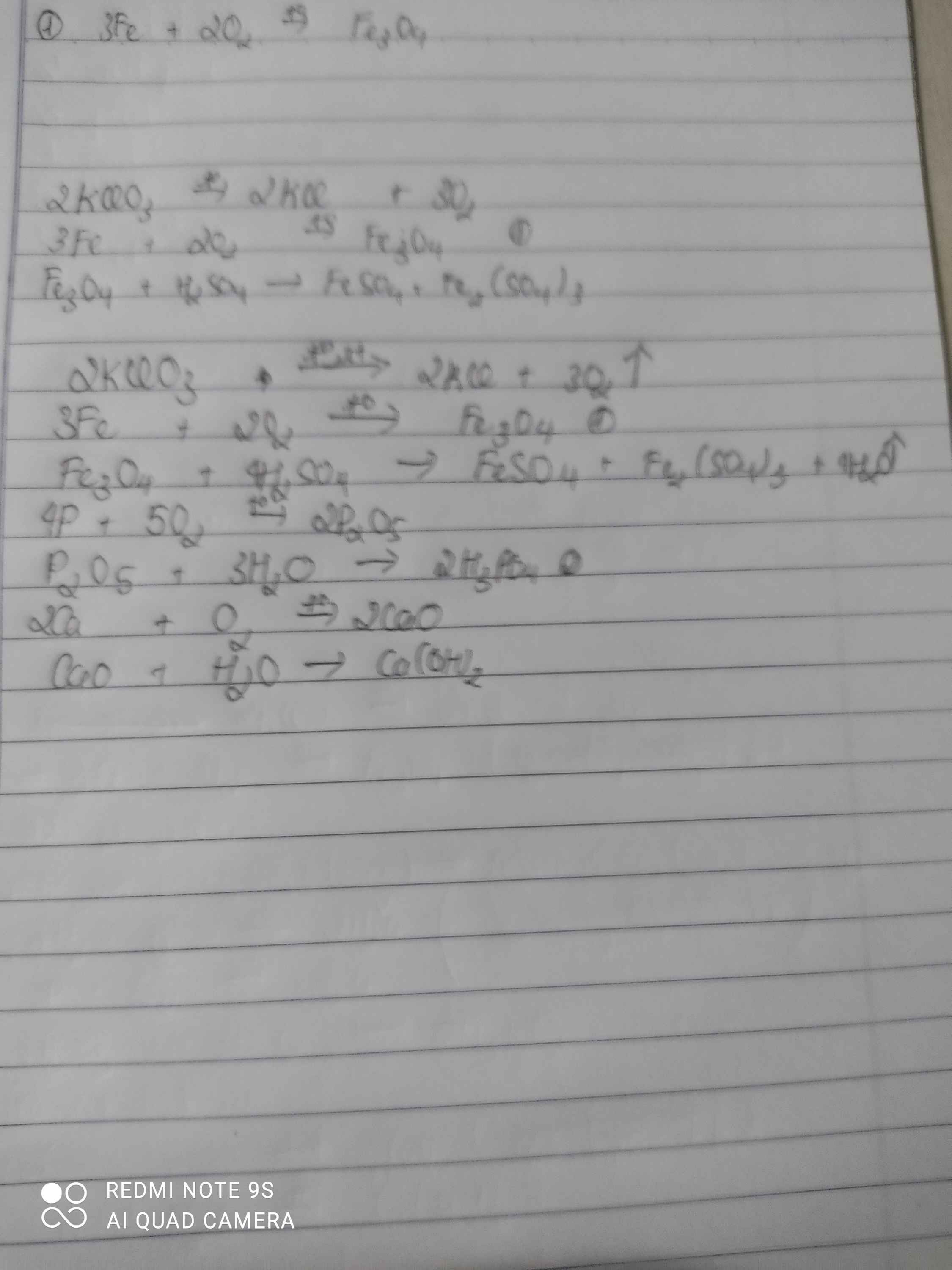
Điều chế Fe:
\(2H_2O\rightarrow2H_2+O_2\) (điện phân)
\(4FeS_2+11O_2\rightarrow2Fe_2O_3+8SO_2\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
Điều chế FeSO4:
\(2SO_2+O_2\rightarrow2SO_3\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(H_2SO_4+Fe\rightarrow FeSO_4+H_2\)