Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

H2S:xmol;H2:ymol
ppe:x+y=0.3
nhh=x+y=0.3=>V=6.72l
34x+2y=18*(x+y)
x=0.15;y=0.15
FeS-->H2S
0.15 0.15
Fe+S-->FeS(1)
0.3 0.2 0.2
(1)=>nFeS lt=0.2
H=nFeS tt/nFeS lt *100=75%
H2S:xmol;H2:ymol
ppe:x+y=0.3
nhh=x+y=0.3=>V=6.72l
34x+2y=18*(x+y)
x=0.15;y=0.15
FeS-->H2S
0.15 0.15
Fe+S-->FeS(1)
0.3 0.2 0.2
(1)=>nFeS lt=0.2
H=nFeS tt/nFeS lt *100=75%

a) chất rắn A là S dư. khí C gồm có H2S và H2 ( dùng đường chéo sẽ tìm đc tỉ lệ số mol là 1 : 1)


→ nH2 = 0,03
Al2S3 + 6HCl → 2AlCl3 + 3H2S↑
0,01 ← 0,03
2Al + 6HCl → 2AlCl3 + 3H2↑
→ nH2 = 0,03 → nAl = 0,02
2Al + 3S → Al2S3
Pư: 0,02 0,03 ←0,01
Dư: 0,02 0,00125
Bđ: 0,04 0,03125
=> %Al = 51,92%
%S = 48,08%

PT: \(Fe+S\underrightarrow{t^o}FeS\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(FeS+H_2SO_4\rightarrow FeSO_4+H_2S\)
\(H_2S+Pb\left(NO_3\right)_2\rightarrow2HNO_3+PbS\)
Ta có: mS (chưa pư) = 1,6 (g)
Theo PT: \(n_{S\left(pư\right)}=n_{FeS}=n_{H_2S}=n_{PbS}=\dfrac{43,02}{239}=0,18\left(mol\right)\)
⇒ ΣmS = 1,6 + 0,18.32 = 7,36 (g) = b
Ta có: dB/H2 = 10,6
\(\Rightarrow\dfrac{2n_{H_2}+34n_{H_2S}}{n_{H_2}+n_{H_2S}}=10,6.2\Rightarrow\dfrac{2n_{H_2}+34.0,18}{n_{H_2}+0,18}=10,6.2\)
\(\Rightarrow n_{H_2}=0,12\left(mol\right)\)
Theo PT: nFe (chưa pư) = nH2 = 0,12 (mol)
nFe (pư) = nFeS = 0,18 (mol)
⇒ mFe = (0,12 + 0,18).56 = 16,8 (g) = a

Gọi x,y lần lượt là số mol Mg, Fe
Mg + S ⟶ MgS
Fe + S ⟶ FeS
MgS + 4H2SO4 → MgSO4 + 4H2O + 4SO2
2FeS + 10H2SO4 → Fe2(SO4)3 + 9SO2 + 10H2O
S + 2H2SO4 → 3SO2 + 2H2O
Ta có :
\(\left\{{}\begin{matrix}Mg:x\left(mol\right)\\Fe:y\left(mol\right)\end{matrix}\right.\underrightarrow{+S:0,5\left(mol\right)}\left\{{}\begin{matrix}MgS:x\left(mol\right)\\FeS:y\left(mol\right)\\S_{dư}:0,5-\left(x+y\right)\left(mol\right)\end{matrix}\right.\underrightarrow{+H_2SO_4}\left\{{}\begin{matrix}MgSO_4:x\left(mol\right)\\Fe_2\left(SO_4\right)_3:\dfrac{y}{2}\left(mol\right)\\SO_2\end{matrix}\right.\underrightarrow{+NaOH\left(dư\right)}\left(kt\right)\left\{{}\begin{matrix}Mg\left(OH\right)_2:x\left(mol\right)\\Fe\left(OH\right)_3:y\left(mol\right)\end{matrix}\right.\underrightarrow{to}\left\{{}\begin{matrix}MgO:x\left(mol\right)\\Fe_2O_3:\dfrac{y}{2}\left(mol\right)\end{matrix}\right.\)
Ta có :\(n_{SO_2}=4x+4,5y+\left[0,5-\left(x+y\right)\right].3=2\left(mol\right)\)
\(40x+160\dfrac{y}{2}=24\)
=> \(\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\)
=> \(m_{Mg}=0,2.24=4,8\left(g\right)\)
\(m_{Fe}=0,2.56=11,2\left(g\right)\)
\(m=4,8+11,2=16\left(g\right)\)
\(\%m_{Mg}=\dfrac{4,8}{16}.100=30\%\)
\(\%m_{Fe}=100-30=70\%\)

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

Bảo toàn e cho toàn quá trình.
Chất khử là Al,chất oxh là N+5
đặt số mol NO2l= là x, NÓ là y.
Ta có
-theo bài ra : x+y=0,04
-theo bảo toàn e : x+3y=(0,54/27)*3=0,06
giải ra đươc x=0,03 y=0,01
M hh khí = (0,03*46+0,01*30)/0,04=42
tỉ khối = 21


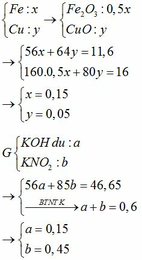
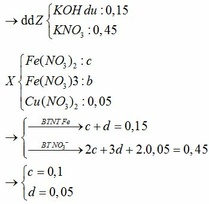

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%