Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
TH1: n lẻ => công thức oxit R2On.
Ta có: 

=> n = 5; R = 31 thỏa mãn
Vậy R là P
TH2: n chẵn Công thức oxit là Ron.
Ta có:
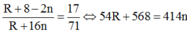
=> không có trường hợp nào thỏa mãn
R là P. Từ đó ta có:
A đúng: P có cấu hình là: 1s22s22p63s23p3
P có 3 electron độc thân
B đúng: P có số oxi hóa 0 trung gian.
C đúng: thiếu clo: ![]()
dư clo![]()
D sai: P2O5 là chất rắn; tan trong nước tạo dung dịch axit
![]()
(điều chế axit photphoric)

Vì nguyên tố R tạo với hidro hợp chất khí có công thức RH3
=> Oxit cao nhất của R là R2O5
Lại có trong R2O5, oxi chiếm 56,34% về khối lượng
=> \(\frac{16\times5}{2R+16\times5}\times100\%=56.34\%\)
=> R = 31
=> R là Photpho

3. Khối lượng mol của hợp chất đó là :
2.28 = 56 (g/mol)
mC = \(\frac{56.85,7}{100}\approx48\left(g\right)\)
mH = 56 - 48 = 8 (g)
nC = \(\frac{48}{12}=4\left(mol\right)\)
nH = \(\frac{8}{1}=8\left(mol\right)\)
Vậy công thức hóa học là C4H8.

Đáp án A.
Hợp chất khí với Hidro của R có công thức là RHx ( 4
≥
x
≥
1) => Oxit cao nhất của R là ![]() . Theo đề bài ta có:
. Theo đề bài ta có:

Ta có:
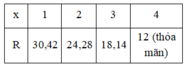
Vậy R là C
=> Hợp chất khí với Hidro là CH4 và Oxit cao nhất là CO2
Nhận xét các đáp án:
A đúng: Do CO2 có cấu trúc mạch thẳng O – C – O nên lực hút của nguyên tử Oxi triệt tiêu lẫn nhau CO2 có liên kết cộng hóa trị giữa nguyên tử C và O phân cực nhưng phân tử CO2 không phân cực.
B sai: Ở điều kiện thường CO2 là hợp chất khí.
C sai: Trong bảng tuần hoàn C thuộc chu kì 2.
D sai: Ở trạng thái cơ bản C có 4 electron s.

Gọi hợp chất khí giữa R và H là: \(H_xR\)
Theo đề bài ta có:
\(\frac{1x}{M_R}=\frac{5,88}{94,12}\)
\(\Rightarrow M_R=\frac{94,12x}{5,88}=\frac{2353x}{147}\)
Lập bảng:
| x | 1 | 2 | 3 |
| MR | 16 (loại) | 32 (nhận) | 48(loại) |
\(\Rightarrow R:S\) (Lưu huỳnh)
Ta có: \(d_{Y/H_2}=\frac{M_Y}{M_{H_2}}\Rightarrow M_Y=32.2=64\)
\(CT:S_xO_y\)
\(\Rightarrow32x+16y=64\)
\(\Leftrightarrow2x+y=2\)
\(\Leftrightarrow2x=2-y\)
...............................
\(\Leftrightarrow\frac{x}{y}=\frac{1}{2}\)
\(\rightarrow CTHH:SO_2\)

Hợp chất khí của R với hiđro có công thức phân tử là RH3.
Hợp chất oxit cao nhất của nguyên tố R là R2O5
Ta có \(\%O=\dfrac{16.5}{2R+16.5}.100=56,34\\ \Rightarrow R=31\left(Photpho-P\right)\\ \Rightarrow Z_R=SốE=15\)

gọi hợp chất R với O là R2On=> hợp chất R với H là RH8-n
ta có ptr : R/(R+8-n): 2R/(2R+16n)=11:4
=> R=(43n-88)/7
n=4 =>R=12 la Cacbon
Đáp án D
TH1: n lẻ ⇒ công thức oxit R2On.
Ta có:
n
1
3
5
7
R
âm
3,2
31
49,5
⇒ n = 5; R = 31 thỏa mãn
Vậy R là P
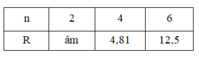
TH2: n chẵn ⇒ Công thức oxit là Ron.
Ta có
n
2
4
6
R
âm
4,81
12,5
⇒ không có trường hợp nào thỏa mãn
R là P. Từ đó ta có:
A đúng: P có cấu hình là: 1s22s22p63s23p3
P có 3 electron độc thân
B đúng: P có số oxi hóa 0 trung gian.
C đúng: thiếu clo:
dư clo:
D sai: P2O5 là chất rắn; tan trong nước tạo dung dịch axit