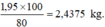Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án C
m H F = 200 . 40 100 = 80 (gam) => n H F = 80 20 = 4 (mol)
m C a F 2 = 4 . 1 2 . 78 . 100 80 = 195 (gam)

mHF =\(\frac{40.2,5}{100}\) = 1kg
Phương trình phản ứng hóa học:
CaF2 + H2SO4 ---> CaSO4 + 2HF
78kg 40kg
X kg 1 kg
mCaF2 cần dùng: \(\frac{1.78}{40}.\frac{100}{80}\) = 2,4375 kg
mHF = = 1kg
Phương trình phản ứng hóa học:
CaF2 + H2SO4 CaSO4 + 2HF
78kg 40kg
X kg 1 kg
cần dùng:
= 2,4375 kg

Đáp án D
![]() .100 = 40% => mHF =160 (g) => n HF = 8 (mol)
.100 = 40% => mHF =160 (g) => n HF = 8 (mol)
CaF2 + H2SO4 → CaSO4 + 2HF
4 ← 8 (mol)
Do H% = 60%=> ![]() = 5 mol
= 5 mol
m = 5. (40+19.2) = 390 (g)

mHF = 40 x 2,5 / 100 = 1kg.
Phương trình hóa học của phản ứng:
CaF2 + H2SO4 \(\rightarrow\) CaSO4 + 2 HF
nHF = 1/20 mol.
nCaF2 = 1/40 mol.
mCaF2 = 1/40 x 78 = 1,95.
mCaF2 cần dùng = 1,95 x 100 / 80 = 2,4375kg.
CaF2 + H2SO4 \(\Rightarrow\) CaSO4 + 2HF theo phương trình ta có: nCaF2=1/2nHF=0,025mol nCaF2 Cần dùng =0,025/80%=0,03125mol mCaF2 cần dùng =0,03125.78=2,4375g

Chọn đáp án D
m H F = 400 . 40 100 = 160 (gam) → n H F = 160 20 = 8 (mol)
Bảo toàn F có: n H F = 2. n C a F 2 → n C a F 2 = 4 mol.
m C a F 2 = 4 , 78 80 % = 390 (gam)

1.
a/ - Cho dd H2SO4 loãng t/d với Fe.
Fe + H2SO4 -> FeSO4 + H2O
=> H2SO4 có tính chất hóa học (tchh) của axit: t/d với KL đứng trước H sinh ra muối và khí H2.
- Cho dd H2SO4 l~t/d với CuO.
CuO + H2SO4 -> CuSO4 + H2O
=> H2SO4 có tchh của axit: t/d với oxit bazơ tạo ra muối và nước.
- Cho dd H2SO4 t/d với KOH.
2KOH + H2SO4 -> K2SO4 + 2H2O
=> H2SO4 có tchh của axit: t/d với dd kiềm cho ra muối và nước.
b/ - Cho H2SO4 đặc t/d với Cu.
Cu + 2H2SO4 đ --t*--> CuSO4 + SO2 + 2H2O
=> H2SO4 đặc có tchh riêng: t/d được với Cu, sinh ra khí SO2 (KL đứng sau H).
- Cho H2SO4 đặc t/d với Fe.
2Fe + 6H2SO4 đ --t*--> Fe2(SO4)3 + 6H2O + 3SO2
=> H2SO4 đặc có tchh riêng: t/d với KL sinh ra muối và giải phóng SO2; đẩy được Fe lên hóa trị cao nhất.
- Cho H2SO4 đặc vào C6H12O6.
C6H12O6 ----H2SO4 đ, t*---> 6C + 6H2O
=> H2SO4 đặc có tchh riêng: có tính háo nước.
2. Gọi số mol của CuO và ZnO lần lượt là a và b.
n HCl = Cm.V = 3.0,1 = 0,3 mol.
a/ CuO + 2HCl -> CuCl2 + H2O
_1_____2 (mol)
_a_____2a
ZnO + 2HCl -> ZnCl2 + H2O
_1______2 (mol)
_b_____2b
Theo đề bài, ta có hệ phương trình:
80a + 81b = 12,1 (m hh)
2a + 2b = 0,3 (n HCl)
Giải hệ, được: a = 0,05; b = 0,1.
b/ m CuO = n.M = 80a = 80.0,05 = 4 (g).
=> % mCuO = (mCuO / mhh) . 100% = 33,06 %.
=> % mZnO = 100% - 33,06% = 66,94 %.
c/ CuO + H2SO4 -> CuSO4 + H2O
___1______1 (mol)
___0,05__0,05
ZnO + H2SO4 -> ZnSO4 + H2O
_1_____1 (mol)
_0,1__0,1
Tổng số mol H2SO4 = 0,05 + 0,1 = 0,15 mol.
=> m H2SO4 = n.M = 0,15.98 = 14,7 g.
=> mdd H2SO4 = (mct.100%) / C% = (14,7.100)/20 = 73,5 g.

Phương trình hóa học của phản ứng:
mCaF2 cần dùng: