Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 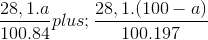 = 0,2
= 0,2
=> a = 29,89.

- Từ dung dịch AgNO3 có 3 cách để điều chế Ag:
+ Dùng kim loại có tính khử mạnh hơn để khử ion Ag+.
Cu + 2 AgNO3 → Cu(NO3)2 + 2Ag
+ Điện phân dung dịch AgNO3:
4AgNO3 + 2H2O 4Ag + O2 + 4HNO3
+ Cô cạn dung dịch rồi nhiệt phân AgNO3:
2AgNO3 2Ag + 2NO2 + O2
- Từ dung dịch MgCl2 điều chế Mg: chỉ có một cách là cô cạn dung dịch để lấy MgCl2 khan rồi điện phân nóng chảy:
MgCl2 Mg + Cl2.
\(4AgNO_3+2H_2O\) \(\underrightarrow{dpdd}\) \(4Ag+O_2\uparrow+4HNO_3\)
\(2AgNO_3\) \(\underrightarrow{t^o}\) \(2Ag+2NO_2+O_2\)
\(MgCl_2\) \(\underrightarrow{dpnc}\) \(Mg+Cl_2\)

Chọn B.
Để hạn chế các khí độc thoát ra từ ống nghiệm ta phải dùng dung dịch tẩm vào bông tẩm có tính kiềm.
Vì Ca(OH)2 phản ứng nhanh, hiệu quả, dễ kiếm và chi phí thấp nên Ca(OH)2 thỏa mãn

Chọn B.
Để hạn chế các khí độc thoát ra từ ống nghiệm ta phải dùng dung dịch tẩm vào bông tẩm có tính kiềm.
Vì Ca(OH)2 phản ứng nhanh, hiệu quả, dễ kiếm và chi phí thấp nên Ca(OH)2 thỏa mãn

Chọn B.
Chất thỏa mãn:
+ tác dụng các khí trên
+ Dễ tìm, giá cả hợp lí.
→ Nước vôi trong: Ca(OH)2

C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Y(AgCl, Ag) + HNO3 --> ...
Ag + 2HNO3 → AgNO3 + NO2 ↑ + H2O

-\(n_{Fe}=\frac{11,2}{56}=0,2mol\) \(n_{Al}=\frac{m}{27}mol\) |
-khi thêm \(Fe\) vào cốc đựng \(HCl\) ( cốc A ) có phản ứng: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) 0,2 0,2 |
theo định luật bảo toàn khối lượng, khối lượng cốc \(HCl\) tăng thêm: \(11,2-\left(0,2.2\right)=10,8g\) |
khi thêm \(Al\) vào cốc đựng dd \(H_2SO_4\) có phản ứng: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\) \(\frac{m}{27}mol\) \(\rightarrow\) \(\frac{3.m}{27.2}mol\) |
| khi cho \(m\) gam \(Al\) vào cốc B, cốc B tăng thêm : \(m-\frac{3.m}{27.2}mol\) |
để cân thăng bằng, khối lượng ở cốc đựng \(H_2SO_4\) cũng phải tăng thêm 10,8g.Có: \(m-\frac{3.m}{27.2}.2=10,8\)
|
| giải ra được \(m=\) \(\left(g\right)\) |

b)
= 10 (gam)
=> phản ứng =
= 0,01 (mol)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,005 0,01 0,01 (mol)
Khối lượng của vật sau phản ứng là:
10 + 108.0,01 - 64.0,005 = 10,76 (gam)


Đáp án A
Để hạn chế các khí độc thoát ra từ ống nghiệm ta phải dùng dung dịch tẩm vào bông tẩm có tính kiềm.
Vì Ca(OH)2 phản ứng nhanh, hiệu quả, dễ kiếm và chi phí thấp nên Ca(OH)2 thỏa mãn