Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta gọi nC=x ;nH=y ta được 12x+y=4,64
Ta có: m dd giảm=mkếttủa - (mCO2 + mH2O) => mCO2+mH2O
=mkettua- mdd giảm=39,4-19,912=19,488g
=> 44x+18.0,5y=10,688
Giải hpt: x=0,348; y=0,464 => x:y=3:4
=> CTĐGN của X là C3H4 => CTPT là C3H4.

\(\begin{cases}C_2H_6:0.2mol\\C_3H_{8:}:0.8mol\end{cases}\)=> M=41.2=>\(\begin{cases}Y\\H_2\end{cases}\)(M=27)
phản ứng đè H2 chọn số mol trước phản ứng n1=1mol
n2là số mol sau pư:
\(\frac{n_1}{n_2}=\frac{M_2}{M_1}\)=> \(n_2=\frac{M_1.n_1}{M_2}=1,5259mol\)
=> nH2=n2-n1=0.5259 mol
=> H=\(\frac{0.5259}{1}.100\)=52.59%
=> A

C4H7OH(COOH)2 + 2NaOH---> C4H7OH(COONa)2 + 2H2O)
C4H7OH(COONa)2+ 2HCl ----> C4H7OH(COOH)2+ 2NaCl
C4H7OH(COOH)2 + 3Na----> C4H7ONa(COONa)2+ 3/2 H2
0,1 0,15 mol
=> nH2= 0,15 mol
Từ các phản ứng trên ta suy ra X là anhiđrit có công thức là (HO − CH2 − CH2−CO)2O
Từ đó suy ra Z là acid có công thức : HOCH2CH2COOH
Khi lấy 0,1 mol Z tác dụng với NaOH thì ta thu được 0,1 mol H2.
Chọn B

Câu 1:
C. H2SO4 loãng; BaCl2; Zn.
Câu 2:
D. Ca(HCO3)2 và MgCl2
Câu 3:
B. 8,96gam
Câu 4:
D. 9,04 gam
Câu 5:
C. Hàm lượng cacbon trong thép từ 2 -3% khối lượng
Câu 6:
D. hematit
Câu 7:
D. Mg, Al, Zn
Câu 8:
B. [Ar]3d54s1
Câu 9:
C. Sắt có tính dẫn điện, dẫn nhiệt tốt và tính nhiễm từ
Câu 10:
A. 4,08
Câu 11:
A. 6,12g
Câu 12:
D. Đun nóng
Câu 13:
B. 0,041
Câu 14:
A. MgO, Al2O3, ,Fe, Cu.
Câu 15:
A. 3,9 gam
Câu 16:
B. Fe, Cu, Cr
Câu 17:
A. Cr(OH)2
Câu 18:
C. Dùng CO khử Al2O3 ở nhiệt độ cao
Câu 19:
B. NaOH.
Câu 20:
C. 5,91g
Câu 21:
C. K
Câu 22:
A. Xuất hiện kết tủa màu xanh, kết tủa không tan và có khí thoát ra.
Câu 23:
A. Cu + O2 + HClà
Câu 24:
A. Điện phân NaCl nóng chảy
Câu 25:
C. Fe2O3, FeCl3
Câu 26:
A. 3
Câu 27:
C. dung dịch Br2
Câu 28:
A. Fe, Al, Zn, Cu
Câu 29:
D. 4

Phản ứng với HCl chứng tỏ axit amino axetic có tính bazo (nhận proton H+)
Phản ứng với NaOH chứng tỏ axit amino axetic có tính axit (cho proton H+)
=> Axit amino axetic có tính lưỡng tính
=> Đáp án A
Hỏi nhiều vào! Mình đang thích học Hóa.Lâu rồi ko online Hóa

Bảo toàn Na: mol NaOH=2*mol Na2CO3 = 0.06
Bảo toàn khối lượng ==> mH2O = 2,76 + 40*0,06 - 4,44 = 0,72 ==> mol H2O = 0,04
CxHyOz + NaOH ---> muối CxHy-1O2Na + H2O (1)
----a--------0,06----------------------------------0,04
muối CxHy-1O2Na + O2 ----> CO2 + H2O + Na2CO3 (2)
------------------------------------0,11---0,05-----0,03
(1)+(2): CxHyO2Na + NaOH + O2 ----> CO2 + H2O + Na2CO3 (2)
-----------------a------------------------------0,11---0,09-----0,03
mol H: ay + 0,06 = 2*0.09 = 0,18 ===> ay = 0,12
Khi A cháy ==> mol H2O = 0,5ay = 0,06 ==> m H2O = 1,08
Theo bài ra, thu được 4,44g 2 muối + nước
\(\Rightarrow\) 2 x 76 + 0,06 x 40 = 4,44 + m(g) nước
A = CxHyO2
nC = 0,14mol; nH = 0,1 + 0,04 − 0,06 = 0,08
nO = \(\frac{2\times76-m_C-m_H}{16}\) = 0,06
\(\Rightarrow\) Công thức phân tử: C7H6O3.
Đốt cháy thu \(n_{H_2O}\) = 0,02 x 3 = 0,06 mol \(\Rightarrow\) \(m_{H_2O}\) = 0,06 x 18 = 1,08 gam.

S(+6, +4, 0, -2). Những hợp chất của S có số oxi hóa cách nhau thì mới phản ứng được vs nhau => gồm (1), (4), (5)
S(+4) có tính khử nên pu đc vs O2



Đáp án D.
Chất oxi hóa được C ở điều kiền thích hợp là: SiO2; CuO; KClO3; CO2; H2O.
SiO2 + C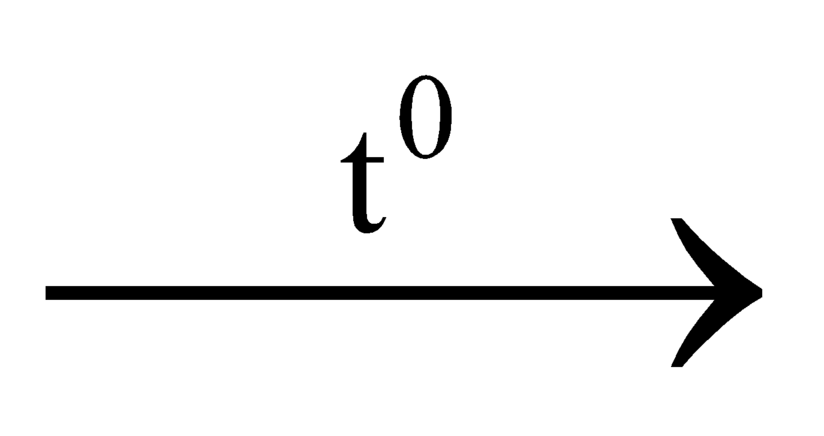 Si + CO2
Si + CO2
CuO + C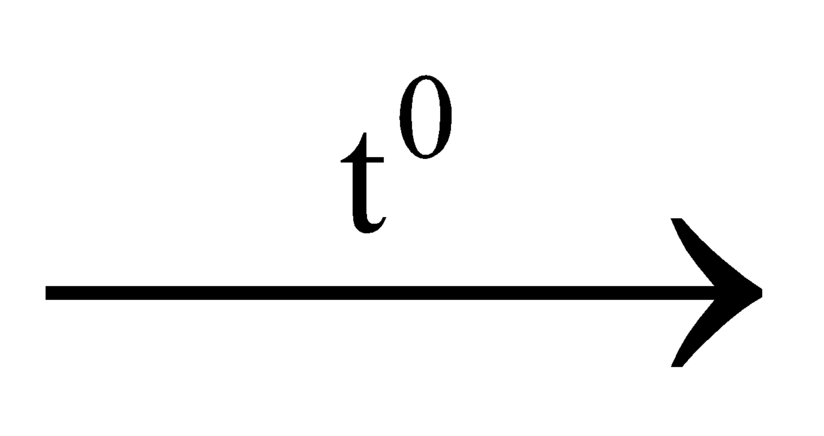 Cu + CO
Cu + CO
2KClO3 + 3C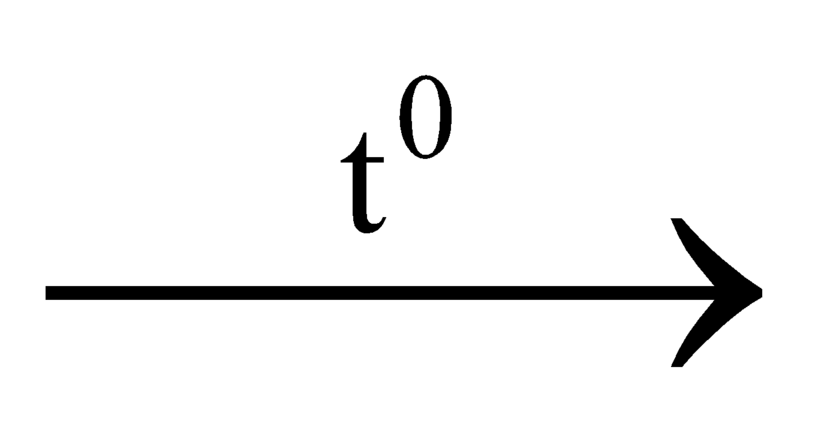 2KCl + 3CO2
2KCl + 3CO2
C + CO2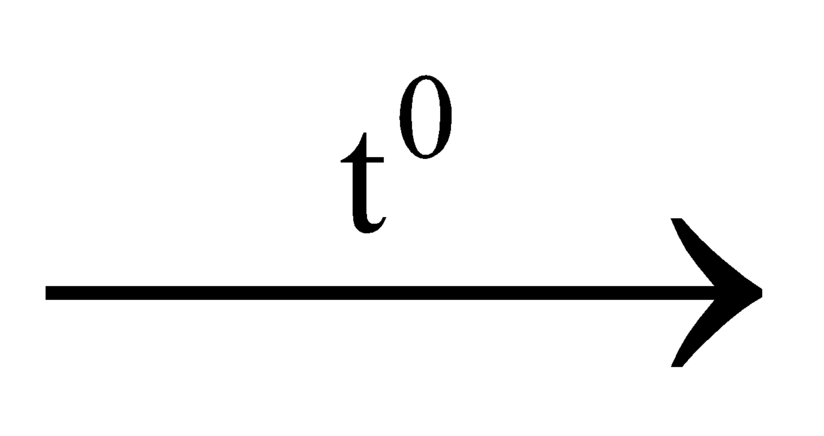 2CO
2CO
C + H2O CO + H2
CO + H2