Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn A.
Khí duy nhất thoát ra tại anot là Cl2 (0,14 mol) Þ ne = 0,28 mol Þ nCu = 0,14 mol
Dung dịch sau điện phân chứa Cu2+ dư và H+ (chưa điện phân)
⇒ C u N O 3 2 0 , 02 m o l H C l 0 , 04 m o l
Dung dịch X (tính cho P2) chứa HCl (0,8 mol) và Cu(NO3)2 (0,32 mol)
Khi cho Fe tác dụng với dung dịch trên thì:

Hỗn hợp rắn gồm: 64.0,32 + m – 56.0,62 = 0,75m Þ m = 56,96 (g)

Đáp án B
Trong mỗi phần chứa nCu(NO3)2 = a và nHCl = b
Cu(NO3)2 +2HCl → Cu + Cl2 + 2HNO3
0,14 ←0,28 ←0,14 →0,28
Dung dịch sau điện phân chứa Cu(NO3)2 dư ( a – 0,14) ; HCl dư (b – 0,28) và HNO3 ( 0,28)
nNaOH = 2 ( a – 0,14 ) + ( b – 0,28) + 0,28 = 0,44 (1)
nCu(OH)2 ↓= a – 0,14 = 0,02 (mol) (2)
Từ (1) và (2) => a = 0,16 và b = 0,4
Phần 2:
nHCl = 0,4 mol => nNO = 0,1 => VNO = 2,24 (lít)
Bảo toàn electron:
2nFe pư = 2nCu2+ + 3nNO => nFe pư = 0,31 (mol)
=> m – 0,31.56 + 0,16.64 = 0,7m
=> m = 23,73 (g)
Vậy m = 23,73 g và V = 2,24 lít

Trong mỗi phần chứa nCu(NO3)2 = a và nHCl = b
Cu(NO3)2 +2HCl → Cu + Cl2 + 2HNO3
0,14 ←0,28 ←0,14 →0,28
Dung dịch sau điện phân chứa Cu(NO3)2 dư ( a – 0,14) ; HCl dư (b – 0,28) và HNO3 ( 0,28)
nNaOH = 2 ( a – 0,14 ) + ( b – 0,28) + 0,28 = 0,44 (1)
nCu(OH)2 ↓= a – 0,14 = 0,02 (mol) (2)
Từ (1) và (2) => a = 0,16 và b = 0,4
Phần 2:
nHCl = 0,4 mol => nNO = 0,1 => VNO = 2,24 (lít)
Bảo toàn electron:
2nFe pư = 2nCu2+ + 3nNO => nFe pư = 0,31 (mol)
=> m – 0,31.56 + 0,16.64 = 0,7m
=> m = 23,73 (g)
Vậy m = 23,73 g và V = 2,24 lít
Đáp án B

Bạn bấn vào đây, có người hỏi bài này rồi nhá Câu hỏi của Mạc Nhược Ca - Hóa học lớp 12 | Học trực tuyến

a) Đặt \(\hept{\begin{cases}n_{Al}=x\left(mol\right)\\n_{Cu}=y\left(mol\right)\end{cases}}\)
PTHH : \(2Al+3H_2SO_4-->Al_2\left(SO_4\right)_3+3H_2\) (1)
\(Al+6HNO_3-->Al\left(NO_3\right)_3+3NO_2+3H_2O\) (2)
\(Cu+4HNO_3-->Cu\left(NO_3\right)_2+2NO_2+2H_2O\) (3)
Theo pthh (1) : \(n_{Al}=\frac{2}{3}n_{H_2}=0,2\left(mol\right)\) => \(x=0,2\left(mol\right)\)
Theo ptr (2); (3) : \(n_{NO_2}=3n_{Al}+2n_{Cu}\)
=> \(0,8=0,2\cdot3+2\cdot n_{Cu}\)
=> \(n_{Cu}=0,1\left(mol\right)\)
=> \(a=0,2\cdot27+0,1\cdot64=11,8\left(g\right)\)
b) PTHH : \(NH_3+HNO_3-->NH_4NO_3\) (4)
\(3NH_3+3H_2O+Al\left(NO_3\right)_3-->Al\left(OH\right)_3\downarrow+3NH_4NO_3\) (5)
\(2NH_3+2H_2O+Cu\left(NO_3\right)_2-->Cu\left(OH\right)_2\downarrow+2NH_4NO_3\) (6)
BT Al : \(n_{Al\left(OH\right)_3}=n_{Al}=0,2\left(mol\right)\)
BT Cu : \(n_{Cu\left(OH\right)_2}=n_{Cu}=0,1\left(mol\right)\)
=> \(m\downarrow=m_{Al\left(OH\right)_3}+m_{Cu\left(OH\right)_2}=25,4\left(g\right)\)
c) Gọi tên KL là X .
PTHH : \(2Al\left(NO_3\right)_3-t^o->Al_2O_3+6NO_2+\frac{3}{2}O_2\) (7)
\(Cu\left(NO_3\right)_2-t^o->CuO+2NO_2+\frac{1}{2}O_2\) (8)
\(4NO_2+O_2+2H_2O-->4HNO_3\) (9)
\(3X+4nHNO_3-->3X\left(NO_3\right)_n+nNO+2nH_2O\) (10)
viết ptr rồi, nhưng mik có thắc mắc là cho khí B hấp thụ vô nước => tính đc số mol của hno3, rồi áp vô X là ra, nhưng đề lại cho số mol NO =((( hoặc có thể dùng số mol NO để tính nhưng như thế có hơi thừa ko ? tính ra theo 2 cách thì cx ra 2 kq khác nhau ? ai githich giùm mik, hay mik tính sai hoặc phân tích đề sai nhỉ ?? :D

Phương trình điện phân: 4AgNO3 + 2H2O → 4Ag + O2 + 4HNO3 (1)
Dung dịch Y gồm: AgNO3, HNO3. Cho Fe + dd Y sau phản ứng thu được 14,5g hỗn hợp kim loại nên Fe dư có các phản ứng:
3Fe + 8HNO3 → 3Fe(NO3)3 + 2NO + 4H2O (2)
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (3)
Gọi x là số mol AgNO3 bị điện phân® nHNO3 = x, dung dịch Y: HNO3: x mol; AgNO3 dư: 0,15 –x mol.
Theo (2,3) nFe phản ứng = 3x/8 + (0,15-x)/2 = 0,075 –x/8 mol
nAg = 0,15 – x mol
Vậy mhỗn hợp kim loại = mFedư + mAg =12,6 –(0,075-x/8).56 +(0,15-x).108 =14,5
Suy ra: x= 0,1 mol. Ta có mAg = 0,1.108 ® t = 1,0 h

Chọn A.
Tại thời điểm t (s) tại anot thu được khí Cl2 (0,05 mol) Þ ne (1) = 0,1 mol
Tại thời điểm 3,5t (s) tại anot có:
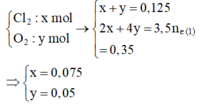
![]() và dung dịch Y chứa Cu2+ dư (a mol), H+ (0,2 mol), NO3-, K+
và dung dịch Y chứa Cu2+ dư (a mol), H+ (0,2 mol), NO3-, K+
Khi cho Y tác dụng với Fe thì: nFe pư =
= 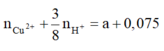
Chất rắn thu được gồm Fe dư và Cu Þ 20 – 56.(a + 0,075) + 64a = 16,4 Þ a = 0,075
Vậy dung dịch X gồm Cu(NO3)2 (0,25 mol) và KCl (0,15 mol) Þ m = 58,175 (g).
Đáp án B
Phần 1 :
Tại A(+) : 2Cl - → Cl2 + 2e
Tại K (-) : Cu2+ + 2e → Cu
Dd thu được tạo kết tủa với NaOH nên Cu2+ còn dư trong dung dịch
H+ + OH- → H2O
Cu2+ + 2OH- → Cu(OH)2
Số mol khí ở anot là : 0,14 mol(Cl2) → nCu (tạo thành ) =0,14.2 :2 =0,14 mol
Cho dung dịch NaOH vào thì
nCu(OH)2 = 1,96 : 98=0,02 mol→ dd sau phản ứng có H+ dư : 0,55.0.8-0,02.2=0,4 mol
→ phần 1 ban đầu có 0,16 mol Cu(NO3)2 và 0,4 mol HCl
Phần 2 :
3Fe + 8H+ + 2 NO3- → 3Fe2+ + 4H2O + 2NO
Ban đầu : 0,4 mol 0,32 mol
Sau PƯ 0 0,22 mol
Fe + Cu2+ → Fe2+ + Cu
0,16 mol
→ nFe phản ứng = 0,15 + 0,16 =0,31 mol
→ mrắn sau phản ứng = m – 0,31.56 + 0,16.64 =0,7 m→ m = 23,73