Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi công thức 2 oxit là A 2 Ox và A 2 Oy, đồng thời kí hiệu A là nguyên tử khối. Ta có tỉ lệ khối lượng oxi trong 2 oxit là : 50% và 60%. Vậy tỉ lệ khối lượng A trong 2 oxit là 50% và 40%.
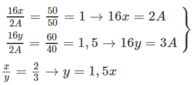
Chỉ có các cặp x, y sau có thể chấp nhận :
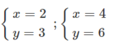
- Nếu chọn x = 2 → ta có 32 = 2A → A = 16 (loại) vì A = 16 là oxi.
- Nếu chọn x = 4 → ta có 64 = 2A → A = 32 → A là lưu huỳnh (S).
Tỉ lệ giữa các nguyên tố là tối giản, ta có hai oxit là : S O 2 và S O 2

- %mN = mN/m(NH2)2CO .100% = 14/60.100%= 70/3= 23.33%
%mN = \(\frac{14.2}{14.2+4+12+16}.100\%=\frac{28}{60}.100\%=46,67\%\)

n CO2=\(\frac{4,48}{22,4}\)=0,1 (mol)
m dd NaOH= 1,05 . 190,48= 200 (g)
==> m NaOH=200 . 0,02%=0,04(g)
---->n NaOH = \(\frac{0,04}{40}\)=0,001 (mol)
CO2 + 2NaOH ------> Na2CO3 + H2O
ban đầu 0,1 0,001 !
pư 0,000 <------- 0,001 -------> 0,001 ----> 0,001 ! (mol)
Sau pư 0,0995 0 0,001 0,001 !
vì sau pư CO2 còn dư nên có thêm pt xảy ra
CO2 + Na2CO3 + H2O -------> 2NaHCO3
ban đầu 0,0995 0,001 !
pư 0,001 <------ 0,001 -----> 0,002 ! (mol)
Sau pư 0,0985 0 0,002 !
sau pư, muối tạo thành là muối axit
m NaHCO3 = 0,002 . 84= 0,168(g)

Số mol C2H5OH = 9,2 : 46 = 0,2 (mol).
Phương trình phản ứng cháy :
C2H5OH + 3O2 -> 2CO2 + 3H2O.
0,2 0,6 0,4 mol
Thể tích khí CO2 tạo ra là : V = 0,4.22,4 = 8,96 (lít).
b) Thể tích khí oxi cần dùng là : V1 = 0,6 . 22,4 = 13,44 (lít).
Vậy thể tích không khí cần dùng là Vkhông khí = (lít).

Gọi phi kim cần tìm là X
=> hợp chất hiđro của X là: XH 3
Ta có: phần trăm khối lượng của hiđro trong hợp chất là 17,65%
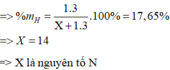
Đáp án: B

Công thức hoá học của hợp chất có dạng XH 3 .
17,65% ứng với (3 x 1)đvC
(100 - 17,65)% ứng với 82,35x3/17,65 = 14(đvC)
Nguyên tử X có nguyên tử khối là 14, vậy nguyên tố X là nitơ (N).
\(X=2,5.16=40\\ \Rightarrow CaO\)
C
Oxit có phần trăm khối lượng của nguyên tố kim loại gấp 2,5 lần phần trăm khối lượng của nguyên tố oxi là CaO