Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

khối lượng thanh kim loại giảm -> nguyển tử khối của KL phải lớn hơn Cu và đứng trước Cu trong dãy điện hóa
khối lượng thanh kim loại tăng -> nguyển tử khối của KL phải nhỏ hơn Ag
=> KL cần tìm là Zn

Để kim loại M đẩy được kim loại X ra khỏi dung dịch muối của nó với phản ứng:
xM (r) + nXx+ (dd) xMn+ (dd) + nX (r)
Phải có điều kiện :
+ M đứng trước X trong dãy thế điện cực chuẩn + Cả M và X đều không tác dụng được với nước ở điều kiện thường + Muối tham gia phản ứng và muối tạo thành phải là muối tan
- Khối lượng chất rắn tăng: ∆m↑ = mX tạo ra – mM tan - Khối lượng chất rắn giảm: ∆m↓ = mM tan – mX tạo ra - Khối lượng chất rắn tăng = khối lượng dung dịch giảm - Ngoại lệ:
+ Nếu M là kim loại kiềm, kiềm thổ (Ca, Sr, Ba) thì M sẽ khử H+ của H2O thành H2 và tạo thành dung dịch bazơ kiềm. Sau đó là phản ứng trao đổi giữa muối và bazơ kiềm + Ở trạng thái nóng chảy vẫn có phản ứng: 3Na + AlCl3 (khan) → 3NaCl + Al + Với nhiều anion có tính oxi hóa mạnh như NO3 – ; MnO 4 – , …thì kim loại M sẽ khử các anion trong môi trường axit (hoặc bazơ)
- Hỗn hợp các kim loại phản ứng với hỗn hợp dung dịch muối theo thứ tự ưu tiên: kim loại khử mạnh nhất tác dụng với cation oxi hóa mạnh nhất để tạo ra kim loại khử yếu nhất và cation oxi hóa yếu nhất - Thứ tự tăng dần giá trị thế khử chuẩn (Eo) của một số cặp oxi hóa – khử: Mg2+/Mg < Al3+/Al < Zn2+/Zn < Cr3+/Cr < Fe2+/Fe < Ni2+/Ni < Sn2+/Sn < Pb2+/Pb < 2H+/H2 < Cu2+/Cu < Fe3+/Fe2+ < Ag+/Ag < Hg2+/Hg < Au3+/Au

Gọi a là nồng độ mol 1 lít dung dịch : FeSO4, CuSO4
Với dd FeSO4: mtăng = a(56 - M) = 16
Với dd CuSO4: mtăng = a(64 - M) = 20
⇒ M = 24 là Mg và a = 0,5

a, \(Zn+CuSO_4\rightarrow ZnSO_4+Cu\)
b, \(m_{giam}=25-24,96=0,04\left(g\right)=m_{Zn_{tan}}=m_{Cu}\)
Đặt a là số mol của Zn tan nên A là mol Cu
\(\Rightarrow65a-64=0,04\)
\(a=0,04\)
\(\Rightarrow m_{Zn_{tan}}=2,6\left(g\right)\)
c,
\(n_{CuSO4}=n_{Cu}=0,04\left(mol\right)\)
\(\Rightarrow m_{CuSO4}=6,4\left(g\right)\)

gọi số mol lần lượt của A và B là x,y mol
A+H2SO4 ---> ASO4+H2
x x x x
2B+3H2SO ---->B2(SO4)3+3H2
y 1,5y y 1
có n H2=8,96/22,4=0,4 mol => x+1,5y=0,4 => N H2SO4=0,4 => m H2SO4=98*0,4=39,2 (g)
có: m hh muối spư=7,8+39,2-2*0,4=46,2 (g) ( theo định luật bảo toàn khối lượng ta có điều ấy)
do: Biết rằng số mol kim loại hóa trị III bằng hai lần số mol kim loại hóa trị II=> y=2x
mà x+1,5y=0,4 => x+1,5*2x=0,4 => x=0,1 mol => y=0,2 mol
do: nguyên tử khối của kim loại hóa trị II bằng 8/9 nguyên tử khối của kim loại hóa trị III.nên có:
A=8/9B
vì:tổng khối lượng của 2kl là 7,8g =>ta có: Ax+By=7,8 (g) (1)
thay x=0,1,y=0,2 mol và A=8/9B vào (1) ta đc:
8/9B*0,1+B*0,2=7,8 => B=27 => A=8/9*27=24
vậy B là Al,A là Mg
Chúc em học tốt!!!


M + Fe2+ M2+ + Fe↓ (1)
M2+ + Fe↓ (1)
2x 2x 2x
Δm%↓ = = 6% (2)
= 6% (2)
M + 2Ag+ M2+ + 2Ag↓ (3)
M2+ + 2Ag↓ (3)
x/2 x x
Δm%↑ =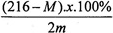 = 25% (4)
= 25% (4)
Từ (2) và (4)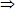

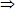 M = 65 (Zn).
M = 65 (Zn).