Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 93 :D
Cho nước vào mẫu thử :
- mẫu thử không tan là MgO
$P_2O_5 + 3H_2O \to 2H_3PO_4$
$CaO + H_2O \to Ca(OH)_2$
Cho giấy quỳ tím vào dung dịch trên :
- mẫu thử hóa đỏ là $P_2O_5$
- mẫu thử hóa xanh là $CaO$
- mẫu thử không đổi màu là $Na_2SO_4$
Câu 92 : D

\(\%N=100\%-61,017\%-15,254\%=23,729\%\)
Gọi CTTQ của X : CxHyNt (x,y,t nguyên dương)
\(x:y:t=\dfrac{\%C}{12}:\dfrac{\%H}{1}:\dfrac{\%N}{14}=\dfrac{61,017}{12}:\dfrac{15,254}{1}:\dfrac{23,729}{14}=3:9:1\)
\(\rightarrow CTĐGN:\left(C_3H_9N\right)\)
\(d_{\dfrac{X}{H2}}=\dfrac{M_X}{M_{H2}}=29,5\Rightarrow M_X=29,5.2=59\)
\(\Rightarrow\left(12.3+9+14\right).n=59\rightarrow n=1\)
\(\Rightarrow CTPT:C_3H_9N\)
\(CH_3-CH_2-CH_2-NH_2\)
\(CH_3-CH\left(NH_2\right)-CH_3\)
\(CH_3-CH_2-NH-CH_3\)

\(M_X=2.13=26\left(\dfrac{g}{mol}\right)\\ n_C=n_{CO_2}=\dfrac{8,8}{44}=0,2\left(mol\right)\\ n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\rightarrow n_H=0,1.2=0,2\left(mol\right)\\ Đặt:C_aH_b\left(a,b:nguyên,dương\right)\\ Có:a:b=n_C:n_H=0,2:0,2=1:1\\ \Rightarrow CTTQ:\left(CH\right)_m\left(m:nguyên,dương\right)\\ M_{\left(CH\right)_m}=26\\ \Leftrightarrow13m=26\\ \Leftrightarrow m=2\\ \Rightarrow CTPT:C_2H_2\\ CTCT:CH\equiv CH\)
b) Nhận biết C2H2 và CH4
- Dẫn 2 khí qua bình đựng nước brom:
+ Dung dịch Br2 bị mất màu -> C2H2
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
+ Còn lại -> CH4

trong 1 mol hh ban đầu có nH2 =0,75 mol , nC2H4 =0,25 mol
nsau= 2,125.13/34=0,8125
=> nH2 pứ =ntrc -nsau =1- 0.8125=0,1875
=> H= 0,1875/0,75 .100= 25%

1/
\(MA=15.2=\dfrac{30g}{mol}\)
\(nC=\dfrac{\dfrac{80.30}{100}}{12}=2\left(mol\right)\)
\(nH=\dfrac{\dfrac{20.30}{100}}{1}=6\left(mol\right)\)
Vậy CTPT của A là \(C_2H_6\)
2/
pthh:
\(2C_2H_6+7O_2\underrightarrow{t^o}4CO_2\uparrow+6H_2O\)
2mol 7mol 4mol 6mol
\(nO_2=\dfrac{6}{32}=0,1875\left(mol\right)\)
\(\Rightarrow nCO_2=\dfrac{4}{7}.nO_2=\dfrac{4}{7}.0,1875=0,11\left(mol\right)\)
\(mCO_2=0,11.\left(12+16.2\right)=4,7\left(g\right)\)
\(nH_2O=\dfrac{6}{7}.nO_2=\dfrac{6}{7}.0,1825=0,156\left(mol\right)\)
\(mH_2O=0,156.18=2,82\left(g\right)\)
ui sr cái cuối kêu đi tính V ko khí , bổ sung lại :
\(VO_2=0,1875.22,4=4,2\left(l\right)\)
\(\Rightarrow V_{kk}=5.VO_2=5.4,2=21\left(l\right)\)

Gọi CTHH của hchc A là CxHyClz
dA/h2 = 56,5 => MA = 56,5.2 = 113 (g/mol)
Ta có : \(\dfrac{35,5z}{113}.100\%=62,832\%\Rightarrow z=2\)
=> 12x + y + 35,5.2 = 113
=> 12x + y = 42
| x | 1 | 2 | 3 | 4 |
| y | 30 | 18 | 6 | -6 |
| KL | Loại | Loại | TM | Loại |
(những giá trị x >4 đều loại vì y <0)
=> CTHH của A là C3H6Cl2

\(CT:C_xH_y\)
\(M_A=8\cdot2=16\left(g\text{/}mol\right)\)
\(\%C=\dfrac{12x}{16}\cdot100\%=75\%\)
\(\Leftrightarrow x=1\)
\(y=16-12=4\)
\(CT:CH_4\)

a.
BTKL ta có mX = mY => nX . MX = nY . mY
MX / My = nY / mY =0.75
Đặt nX = 1 mol => nY = 0,75 mol => nH2 phản ứng = 1 – 0,75 = 0,25mol
* TH hidrocacbon là anken: n anken = n H2 = 0,25 mol => n H2 trong X = 0,75 => M = (6,75 – 0,75 . 2)/0,25 = 21 (loại) * TH là ankin: => n akin = 0,25/2 = 0,125 => n H2 trong X = 0,875 mol => M = (6,75 – 0,875 . 2)/0,125 = 40 =>C3H4
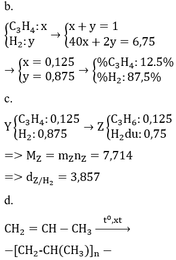

\(M_{hc}=17.M_{H_2}=17.2=34\left(đ.v.C\right)\\ Đặt:H_xS_y\left(x,y:nguyên,dương\right)\\ Ta.có:x=\dfrac{5,88\%.34}{1}=2\\ y=\dfrac{34-2.1}{32}=1\\ \Rightarrow CTHH:H_2S\)