Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

TN1: Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
2FeCl3 + Cu → CuCl2 + 2FeCl2
Vì Cu còn dư 0,1 mol nên sau phản ứng chứa FeCl2 : 3a mol, CuCl2 : a mol
→ a. 232 + 64. ( a + 0,1)= 24,16 → a = 0,06 mol
Vậy X gồm Cu: 0,16 mol và Fe3O4 : 0,06 mol
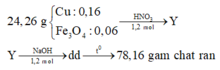
+ Nhận thấy nếu chất rắn chỉ chứa NaNO2 : 0,12 mol thì mchất rắn = 0,12. 69 > 78,16 gam.
⇒ Chất rắn chứa đồng thời NaNO2 : x mol và NaOH : y mol
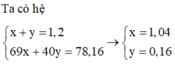
Giả sử sản phẩm khử chứa N và O
Bảo toàn nguyên tố N → nN = 1,2 - 1,04 = 0,16 mol
Bảo toàn electron → 2nCu + nFe3O4 = 5nN - 2nO → nO = 0,21 mol
Bảo toàn khối lượng → mdd = 24,16 + 240 - 0,16.14 - 0,21. 16 = 258,56 gam
%Cu(NO3)2 = 0 , 16 . 188 258 , 56 . 100% = 11,63%.

Đáp án C
Vì số mol của FeO bằng số mol của Fe2O3 nên ta coi hỗn hợp là Fe3O4
Ta có:
Fe3O4 +4H2SO4 → FeSO4 +Fe2(SO4)3 +4H2O
0,02 0,02
Trong 100 ml X sẽ có 0,01 mol FeSO4 nên:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
→ nKMnO4 = 0,02 mol → VKMnO4 = 0,02/0,1 = 0,2 l

Ta có: \(n_{NO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Theo đề bài: \(108n_{Ag}+64n_{Cu}=2,36\) (1)
Bảo toàn electron: \(n_{Ag}+2n_{Cu}=n_{NO_2}=0,05\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Ag}=0,01\left(mol\right)\\n_{Cu}=0,02\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Ag}=\dfrac{108\cdot0,01}{2,36}\cdot100\%\approx45,76\%\\\%m_{Cu}=54,24\%\end{matrix}\right.\)
Ag + 2HNO3 ⟶ AgNO3 + H2O + NO2
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
\(n_{NO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Gọi x,y lần lượt là số mol Ag, Cu
Ta có : \(\left\{{}\begin{matrix}108x+64y=2,36\\x+2y=0,05\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,01\\y=0,02\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}m_{Ag}=0,01.108=1,08\left(g\right)\\m_{Cu}=0,02.64=1,28\left(g\right)\end{matrix}\right.\)
=> \(\%m_{Ag}=\dfrac{1,08}{2,36}.100=45,76\%\)
=>%mCu = 100 - 45,76 =54,24%

Bạn bấn vào đây, có người hỏi bài này rồi nhá Câu hỏi của Mạc Nhược Ca - Hóa học lớp 12 | Học trực tuyến

Vì ta có thể tính được ngay số mol của N2 và H2 và đây cũng là dự kiện mấu chốt để tìm m với dạng toàn này nên đầu tiên ta tìm số mol của N2 và H2 bằng cách: đặt nN2 và H2 lần lượt là x, y. Ta được: x + y = 0,025
tỉ khối so với H2: 28x + 2y/ 2(x + y) = 11,4 (với x + y = 0,025)
=> x = 0,02; y = 0,005
Sử dụng bảo toàn electron: số mol electron nhường = số mol electron nhận thì: 2nMg > ***N2 + 2nH2 nên phản ứng có tạo NH4Cl
quá trình oxi hóa: Mg - 2e -----> Mg2+
quá trình khử: 2NO3- -10e ----> N2 (N(+5) -5e ----> N(0))
NO3- -8e ------> NH4+ (n(+5) - 8e ---> N(-3))
2H+ -2e ---> H2
Vậy 2.0,124 = 0,025.10 + 0,005.2 + 8nNH4+ => nNH4+ = 0,01
m = mMgCl2 + mNH4Cl = 0,145.95 + 0,01.53,5 = 14,31 gam
mol Mg = 0,145 ==> mol e nhường = 0,29 ==> mol NH4+ = 0,01
2 NO3- + 10e + 12 H+ ----> N2 + 6 H2O
0,04-------0,2------0,24-------0,02
NO3- + 8e + 10 H+ ----> NH4+ + 3 H2O
0,01----0,08------0,1-------0,01
2 H+ + 2e ----> H2
0,01----0,01------0,005
mol HCl = mol Cl- = mol H+ = 0,35
mol KNO3 = mol K+ = mol NO3- = 0,05
muối gồm : Mg2+ = 0,145 mol, NH4+ = 0,01 mol, K+ = 0,05 và mol Cl- = 0,35
khối lượng muối = 24*0,145 + 39*0,05 + 35,5*0,35 = 18,035

1.
nH2= 0,075 mol
PTHH:
2Al+ 6HCl→ 2AlCl3 +3H2↑
x___________________3x
Mg+ 2HCl→ MgCl2+ H2↑
y_____________________y
Giải HPT:
\(\left\{{}\begin{matrix}27x+24y=1,5\\1,5x+y=0,075\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=\frac{1}{30}\\y=\frac{1}{40}\end{matrix}\right.\)
⇒ %Al=\(\frac{27.\frac{1}{30}}{1,5}\text{.100%= 60%}\)
2.
nNO2= 0,04 mol
PTHH:
Ag + 2HNO3→ AgNO3+ NO2↑+ H2O
x____________________ y
Cu +4HNO3→ Cu(NO3)2 +2NO2↑ +2H2O
y______________________2y
Ta có hệ pt:
\(\left\{{}\begin{matrix}108x+64y=2,8\\x+2y=0,04\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,02\\y=0,01\end{matrix}\right.\)
⇒ %Ag=\(\frac{0,2.108}{2,8}\text{.100%= 77,14%}\)