Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số electron ở lớp ngoài cùng của nguyên tử Na =1
Số electron ở lớp ngoài cùng của ion Na+ =8
=>Số electron ở lớp ngoài cùng của ion Na+ nhiều hơn số electron ở lớp ngoài cùng của nguyên tử Na
Số electron ở lớp ngoài cùng của nguyên tử Cl =7
Số electron ở lớp ngoài cùng của ion Cl- =8
=>Số electron ở lớp ngoài cùng của ion Cl- nhiều hơn số electron ở lớp ngoài cùng của nguyên tử Cl
Số electron lớp ngoài cùng của `Na` bé hơn ion `Na^+`
Số electron lớp ngoài cùng của `Cl` bé hơn ion `Cl^-`

- Sự thay đổi số electron ở lớp ngoài cùng trong cùng 1 hàng khi đi từ trái sang phải:
+ Hàng thứ 1: Số electron ở lớp ngoài cùng tăng dần từ 1 đến 2
+ Hàng thứ 2: Số electron ở lớp ngoài cùng tăng dần từ 1 đến 8
+ Hàng thứ 3: Số electron ở lớp ngoài cùng tăng dần từ 1 đến 8

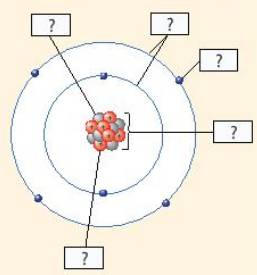
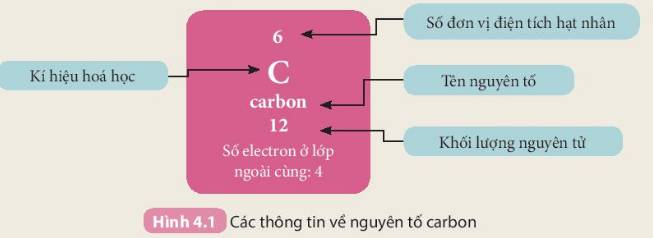
Số electron : 12
Số đơn vị điện tích hạt nhân : + 12
Số hạt electron lớp ngoài cùng : 2
Số electron : 12
Số đơn vị điện tích hạt nhân : + 12
Số hạt electron lớp ngoài cùng : 2

Đầu tiên là F fluorine số electon 19 stt 9 chu kì 2 nhóm VIIA
Thứ 2 là sodium số electon 23 stt 11 chu kì 3 nhóm IA
Cuối cùng là scandium số electon là 45 stt 21 chu kì 4 nhóm IIIB

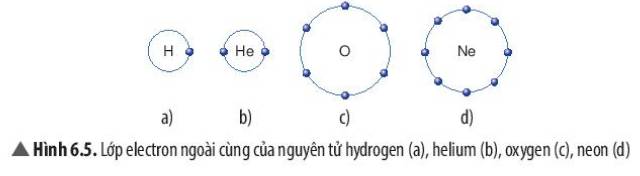
- Xét phân tử hydrogen: mỗi nguyên tử hydrogen có 2 electron lớp ngoài cùng
=> Giống cấu hình electron của nguyên tử khí hiếm Helium
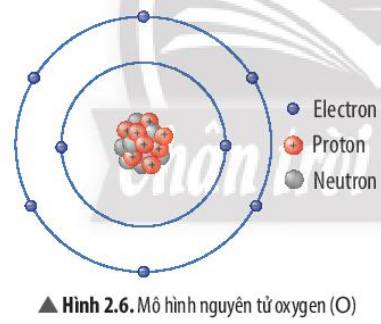
- Xét phân tử Oxygen: mỗi nguyên tử Oxygen có 8 electron ở lớp ngoài cùng
=> Giống cấu hình electron của nguyên tử khí hiếm Neon

`1,`
Số electron lớp ngoài cùng của nguyên tử nguyên tố `Al` là `3`
Gt: Nguyên tố `Al` thuộc nhóm `IIIA`
Vì số nhóm `A` bằng số electron lớp ngoài cùng của các nguyên tử nguyên tố thuộc nhóm đó `-> Al` có `3e` lớp ngoài cùng.
Tương tự, `Cl` thuộc nhóm `VIIA ->` nguyên tố `Cl` có `7e` lớp ngoài cùng.
`2,`
Các nguyên tố thuộc chu kì và cùng nhóm với nguyên tố `Be:`
Chu kì: `Li, B, C, N, O, F, Ne`
Nhóm: `Mg, Ca, Sr, Ba, Ra`
1. Cấu hình e của Al (Z=13): 1s22s22p63s23p1
=> Có 3e lớp ngoài cùng (3e lớp thứ 3)
Cấu hình e của S (Z=16): 1s22s22p63s23p23p4
=> Có 6e lớp ngoài cùng (6e lớp thứ 3)
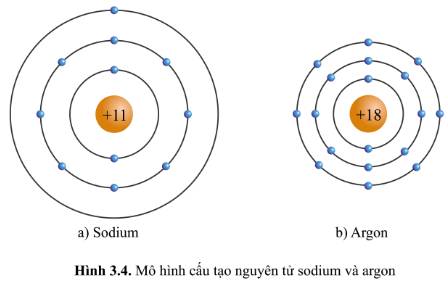
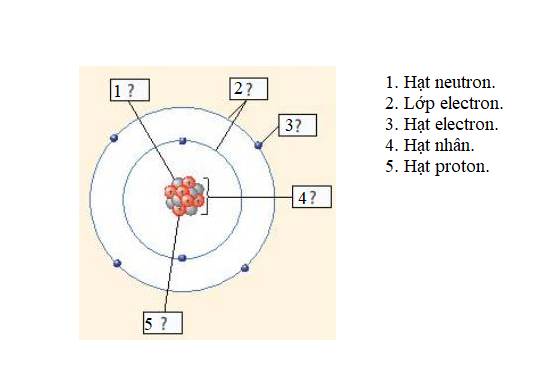




- Xét mô hình nguyên tử natri:
+ Số hiệu nguyên tử: 11
+ Điện tích hạt nhân: +11
+ Có 3 vòng tròn quanh hạt nhân => Số lớp electron = chu kì = 3
+ Có 1 hình tròn xanh ở vòng tròn ngoài cùng => Có 1 electron ở lớp ngoài cùng
- Xét mô hình nguyên tử argon:
+ Số hiệu nguyên tử: 18
+ Điện tích hạt nhân: +18
+ Có 3 vòng tròn quanh hạt nhân => Số lớp electron = chu kì = 3
+ Có 8 hình tròn xanh ở vòng tròn ngoài cùng => Có 8 electron ở lớp ngoài cùng