Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

CHÚC BẠN HỌC TỐT![]()
a) Theo đề bài, ta có: \(n_{O2}=\dfrac{20}{32}=0,625\left(mol\right)\)
PTHH: \(2H_2+O_2\underrightarrow{o}2H_2O\)
pư............1.........0,5......1 (mol)
Ta có tỉ lệ: \(\dfrac{1}{2}< 0,625\). Vậy O2 dư, H2 hết.
\(\Rightarrow m_{H2O}=18.1=18\left(g\right)\)
Vậy.........

Câu 1: PTHH: Fe2O3 + 3CO ===>Fe + 3CO2
Áp dụng định luật bảo toàn khối lượng
=> mFe = mFe2O3 + mCO - mCO2
= 32 + 16,8 - 26,4 = 22,4 kg
Câu 2/
a/ PTHH: CuCO3 ==( nhiệt)==> CuO + CO2
Cu(OH)2 ==(nhiệt)==> CuO + H2O
Áp dụng định luật bảo toàn khối lượng
=> mCO2 = mmalachite - mCuO - mH2O
= 2,22 - 1,60 - 0,18 = 0,44 gam
b/ Áp dụng định luật bảo toàn khối lượng
=> mquặng = mCuO + mCO2 + mH2O
= 6 + 0,9 + 2,2 = 9,1 gam

_ \(m_{Fe_2O_3}=0,8.50=40\left(g\right)\) \(\Rightarrow m_{CuO}=50-40=10\left(g\right)\)
_ \(n_{Fe_2O_3}=\dfrac{40}{160}=0,25mol\); \(n_{CuO}=\dfrac{10}{80}=0,125mol\)
PTHH: \(3H_2+Fe_2O_3\rightarrow2Fe+3H_2O\)
_____0,75mol_0,25mol
\(H_2+CuO\rightarrow Cu+H_2O\)
0,125__0,125 (mol)
\(\Rightarrow V_{H_2}=\left(0,75+0,125\right)22,4=19,6l\)

$a.PTHH :$
$2Fe(OH)_3\overset{t^O}\to Fe_2O_3+3H_2O$
$b.n_{Fe(OH)_3}=\dfrac{32,1}{107}=0,3mol$
$Theo$ $pt :$
$n_{Fe_2O_3}=\dfrac{1}{2}.n_{Fe_2O_3}=\dfrac{1}{2}.0,3=0,15mol$
\(\Rightarrow\)$m_{Fe_2O_3}=0,15.160=24g$

nFe=5,6/56=0,1(mol)
mPb=26,3-5,6=20,7(g)
=>nPb=20,7/207=0,1(mol)
Fe2O3+3H2---t*--->2Fe+3H2O
_______0,15_______0,1
PbO+H2---t*--->Pb+H2O
____0,1________0,1
\(\Sigma nH2=\)0,15+0,1=0,25(mol)
=>VH2=0,25.22,4=5,6(l)

a/ \(n_{O2}=\dfrac{20}{16}1,25mol\)
pt: 2H2+O2->2H2O
Ta có \(\dfrac{0,1}{2}< \dfrac{1,25}{1}\)
=> O2 dư
+>\(n_{H2O}=n_{H2}=0,1mol\)
=> m=0,1.18=1,8g
b/( cậu chắc là đề bài đúng chứ? )
\(m^{_{Cu}}=\dfrac{50.20}{100}=10g\) =>\(n_{Cu}=\dfrac{10}{80}=0,125mol\)
=>\(m_{FeO}=40g\) => \(m_{FeO}=\dfrac{40}{72}mol\)
pt: \(CuO+H_2->H_2O+Cu\)
\(FeO+H_2->H_2O+Fe\)
=> nH2=0,125+\(\dfrac{40}{72}\) mol
=> V= 15,2444 l
(đề bài đúng chứ?)

mFe2O3=80%.50=40(g)
=>nFe2O3=40/160=0,25(mol)
mCuO=50-40=10(g)
=>nCuO=10/80=0,125(mol)
Fe2O3+3H2--t*-->2Fe+3H2O
0,75____0,75
CuO+H2--t*-->Cu+H2O
0,125__0,125
\(\Sigma H_2=\)0,75+0,125=0,875(mol)
=>VH2=0,875.22,4=19,6(l)



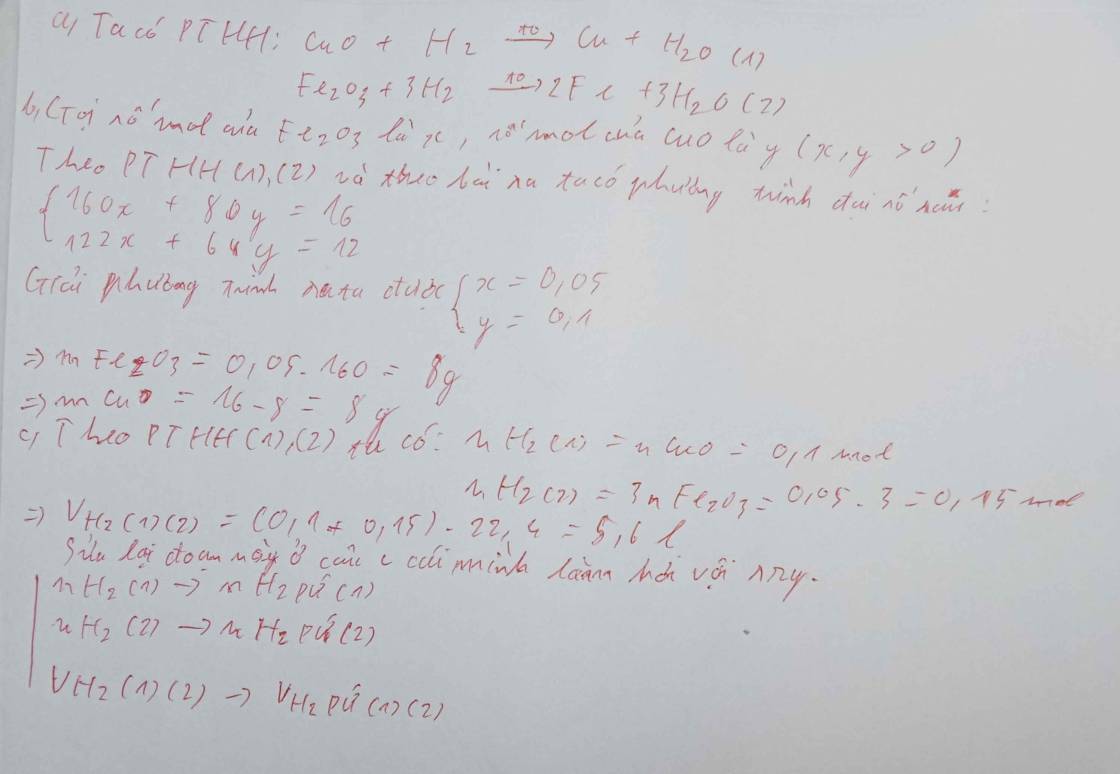
a) PTHH: 3H2 + Fe2O3 \(\rightarrow\) 2Fe + 3H2O(1)
H2 + CuO \(\rightarrow\) Cu + H2O(2)
b) Theo đề, ta có: %m\(Fe_2O_3\) = \(\frac{m_{Fe_2O_3}}{m_{hc}}.100\%\)
=> m\(Fe_2O_3\) = \(\frac{80.25}{100}=20\left(g\right)\)
=> mCuO = 25-20 = 5 (g)
=> n\(Fe_2O_3\) = \(\frac{20}{160}=0,125\left(mol\right)\)
=> nCuO = \(\frac{5}{80}=0,0625\left(mol\right)\)
Theo PT(1): n\(H_2\) = 3n\(Fe_2O_3\) = 3.0,125 = 0,375 (mol)
Theo PT(2): n\(H_2\) = nCuO = 0,0625 (mol)
=> n\(H_2\) cần dùng = n\(H_2\)(1) + n\(H_2\)(2) = 0,375 + 0,0625 = 0,4375 (mol)
=> V\(H_2\) cần dùng = 0,4375.22,4 = 9,8 (l)
mFe2O3= 25*80/100=20g
mCuO= 25-20=5g
nFe2O3= 20/160=0.125 mol
nCuO= 5/80=0.0625 mol
Fe2O3 + 3H2 -to-> 2Fe + 3H2O
0.125___0.375
CuO + H2 -to-> Cu + H2O
0.0625__0.0625
nH2= 0.375+0.0625=0.4376 mol
VH2= 0.4375*22.4=9.8l