Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

công thức oxit của sắt : Fe2Oy
nSO2=0,075 mol
2FexOy + (6x-2y)H2SO4 ---> xFe2(SO4)3 + (3x-2y)SO2 + (6x-2y)H2O
0,25 mol..........................................0,075 mol
theo pt trên ta có
\(\frac{0,25.2}{6x-2y}=\frac{0,075.2}{3x-2y}\)
<=> 0,75x-0,5y=0,45x-0,15y
<=>0,3x=0,35y<=> \(\frac{x}{y}=\frac{0,35}{0,3}=\frac{7}{6}\)
=> oxit sắt là Fe7O6
sao bạn lại để đấp án oxit fe như vậy làm j có công thức oxit fe đó

nCu= x mol; nAg= y mol
Cu + 2H2SO4→ CuSO4 + SO2↑ + H2O (1)
2Ag + 2H2SO4→ Ag2SO4 + SO2↑ + 2H2O (2)
SO2(k) + Br2 + 2H2O → H2SO4 + 2HBr (3)
BaCl2 + H2SO4 → BaSO4↓ + 2HCl (4)
Theo PTPU (4), ta có: n↓= nBaSO4= nH2SO4 (4)= 0,08 mol
Theo PTPU (3), ta có: nSO2= nH2SO4 (4)= 0,08 mol
Theo PTPU (1) và (2), ta có: nSO2= nCu + 2nAg = x + 0,5y = 0,08 mol (5)
Tổng khối lượng hỗn hợp ban đầu: mhỗn hợp= mCu + mAg = 64x + 108y = 11,2 (6)
Giải hệ hai phương trình (5) và (6) ta được: x= 0,04 ; y= 0,08
→mCu= 0,04x64= 2,56 (g) →%mCu=2,56/11,2x100% = 22,86%
→%mAg= 100% - %mCu= 77,14%

X + O2 → Y
Bảo toàn khối lượng có mO2 = 0,48 g → nO2 = 0,015 mol
Quy đổi Y thành kim loại và oxi
Ta có 4H+ + 4e + NO3- → 2H2O + NO
2H+ + O2- → H2O
→ nH+ = 4nNO + 2nO =4.0,03 + 2.0,03= 0,18 mol
Bảo toàn nguyên tố H thì nHNO3 = 0,18 mol
bài2
Ta có: nCO= 0,8 mol; nSO2= 0,9 mol
MxOy + yCO → xM + yCO2 (1)
Ta thấy đáp án M là Fe hoặc Cr nên M có số oxi hóa cao nhất là +3
2M + 6H2SO4 → M2(SO4)3+ 3SO2+ 6H2O (2)
Theo PT (2): nM= 2/3.nSO2= 0,6 mol
Theo PT (1):
x/y=nM/nCO=0,6/0,8=3/4 => Oxit là Fe3O4

Mỗi phần a,b mol Fe , Al
\(n_S=n_{FeSO4}=n_{Fe}=a\left(mol\right)\)
\(n_{Al}=2n_{Al2\left(SO4\right)3}=b\left(mol\right)\)
\(\Rightarrow n_{Al2\left(SO4\right)3}=0,5b\left(mol\right)\)
\(\Rightarrow n_S=3n_{Al2\left(SO4\right)3}=1,5b\left(mol\right)\)
\(\%m_S=23,5204\%\Rightarrow\frac{32\left(a+1,5b\right)}{152a+342b}=0,235204\)
\(\Leftrightarrow-3,751008a-32,439768b=0\left(1\right)\)
\(n_{Br2}=1,245\left(mol\right)\)
\(SO_2+Br_2+2H_2O\rightarrow2HBr+H_2SO_4\)
1,245___1,245________________________
Bảo toàn e: \(3a+3b=1,245.2=2,49\left(2\right)\)
\(\left(1\right)+\left(2\right)\Rightarrow\) Nghiệm âm

\(a.2Fe+6H_2SO_{4\left(đặc\right)}\rightarrow\left(t^o\right)Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\\ n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ n_{Fe}=\dfrac{2}{3}.0,15=0,1\left(mol\right)\\ n_{Fe_2\left(SO_4\right)_3}=\dfrac{0,15}{3}=0,05\left(mol\right)\\ a,m=m_{Fe}=0,1.56=5,6\left(g\right)\\ b,m_{Fe_2\left(SO_4\right)_3}=400.0,05=20\left(g\right)\)
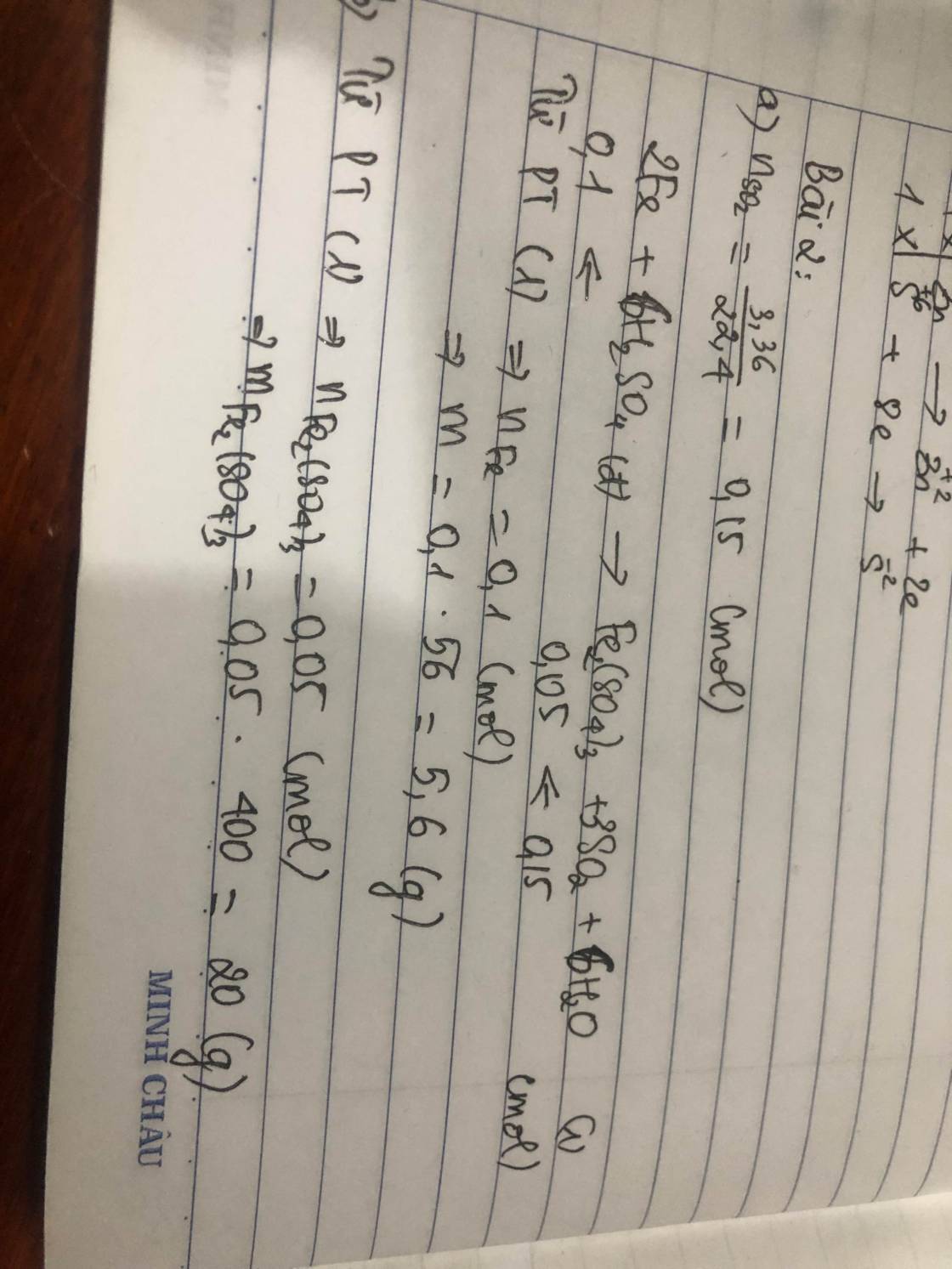
$n_{Mg}=0,4(mol)$
Đặt $a$ là số oxi hóa của $S$ trong $X$
$Mg^0\to Mg^{+2}+2e$
$S^{+6}+(6-a)e\to S^a$
Bảo toàn e: $2n_{Mg}=(6-a)n_S$
$\to 0,8=(6-a).0,4$
$\to a=4$
$\to X$ là $SO_2$
`Mg + H_2 SO_[4(đ)] -> MgSO_4 + H_2 O + SO_2↑`
`-> X` là khí `SO_2`