Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 9 :
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Đặt x, y lần lượt số mol Mg , Zn phản ứng với axit
PTHH :
\(Mg\left(x\right)+H_2SO_4\left(x\right)-->MgSO_4\left(x\right)+H_2\left(x\right)\)
\(Zn\left(y\right)+H_2SO_4\left(y\right)-->ZnSO_4\left(y\right)+H_2\left(y\right)\)
Gỉa sử trong hỗn hợp chỉ có Zn :
\(x+y=n_{Zn}=n_{H_2}=0,1\)
\(\Rightarrow m_{Zn}=0,1.65=6,5\left(g\right)\)
\(\Rightarrow65x+65y=65\left(x+y\right)=6,5\left(g\right)< 7,8\left(g\right)\)
Vậy chứng tỏ axit vẫn dư sau phản ứng .
Bài 7 :
PTHH :
\(Fe+2HCl-->FeCl_2+H_2\left(1\right)\)
\(2Al+6HCl-->2AlCl_3+3H_2\left(2\right)\)
Gỉa sử trong hỗn hợp X chỉ có Fe :
\(n_{Fe}=\dfrac{22}{56}=0,4\left(mol\right)\Rightarrow n_{HCl}=0,4.2=0,8\left(mol\right)\)
\(n_{HCl}=0,6\left(mol\right)< 0,8\left(mol\right)\)
Chứng tỏ kim loại không tan hết .(1)
\(Gỉa\) sử trong hỗn hợp chỉ có Al :
\(n_{Al}=\dfrac{22}{27}=0,814=>n_{HCl}=3.0,814=2,44\left(mol\right)>0,6\left(mol\right)\)
Chứng tỏ kim loại không tan hết (2)
Từ (1),(2) chứng tỏ hh X không tan hết .
HÌNH NHƯ SAI ĐỀ .

PTHH: 2C2H2 + 5O2 → 2H2O + 4CO2
VO2(đktc) = \(\frac{1,12\times20}{100}=0,244\left(lít\right)\)
=> nO2 = 0,224 / 22,4 = 0,01 (mol)
nC2H2 = 0,004(mol)
=> a = 0,004 x 26 = 0,104 (gam)
nH2O = 0,004 (mol)
=> mH2O = 0,004 x 18 = 0,072 (gam) = b
nCO2 = 0,008 (mol)
=> VCO2(đktc) = 0,008 x 22,4 = 0,1792(lít) = c

Câu 1
Gọi n Zn = x ; m Zn = 65x ; n Fe = y và m Fe = 56y
Ta có: 65x + 65y = 37,2 ( 1)
nH2SO4 = 2 . 0,5 = 1 mol
+ Giả sử hỗn hợp tan hết ta có PTPƯ
- Zn + H2SO4 \(\rightarrow\) ZnSO4 + H2 (a)
x x x
- Fe + H2SO4 \(\rightarrow\) FeSO4 + H2 (b)
y y y
a) + 65x + 65y = 37,2
56x + 56y < 65x + 56y
56x + 56y < 37,2
56 ( x + y ) < 37,2
x + y < \(\dfrac{37,2}{56}=0,66\)
+ 65x + 65y > 65x +65y
65x + 65y > 37,5
65 ( x + y ) > 37,2
x + y > \(\dfrac{37,5}{65}=0,75\)
Từ (a) và (b) n H2SO4 = x + y = 1 mol
Mà n2 kim loại 0,57 < x + y < 0,66
==> kim loại tan hết, axit dư
b) Nếu dùng hỗn hợp Zn và Fe gấp đôi thì cũng có lập luận như trên :
Ta có: 1,14 < x + y < 1,32
Mà n H2SO4 = 1mol
Do đó axit phản ứng hết, kim loại dư ( ko tan hết )
Bài 1 :
Theo bài ra :
\(n_{H_2SO_4}=1\left(mol\right)\)
Đặt \(n_{Zn}=a\left(mol\right)\)
\(n_{Fe}=b\left(mol\right)\)
PTHH :
\(Zn\left(a\right)+H_2SO_4\left(a\right)-->ZnSO_4+H_2\)
\(Fe\left(b\right)+H_2SO_4\left(b\right)-->FeSO_4+H_2\)
\(a+b=0,1=>n_{Fe}+n_{Zn}=0,1\left(1\right)\)
Ta gia sử hỗn hợp chỉ chứa Zn :
\(65a+56b\)\(< 65a+65b\)
\(\Rightarrow65a+65b>37,2\)
\(\Rightarrow a+b>\dfrac{37,2}{65}=0,57\left(2\right)\)
Gỉa sử hỗn hợp chỉ sắt :
\(a+b< \dfrac{37,2}{56}=0,66\left(3\right)\)
\(\left(1\right);\left(2\right);\left(3\right)=>0,57< 1< 0,66\left(vô.lí\right)\)
\(\Rightarrow H2SO4.dư,hỗn.hợp.tan.hết\)
b, Nếu dùng gấp đôi Fe và Zn :
\(1,14< 1< 1,32\left(vô.lí\right)\)
Vậy hỗn hợp vẫn không tan hết .

1.
- nFe= \(\dfrac{11,2}{56}\) = 0,2 mol
nAl = \(\dfrac{m}{27}\) mol
- Khi thêm Fe vào cốc đựng dd HCl (cốc A) có phản ứng:
Fe + 2HCl \(\rightarrow\) FeCl2 +H2 \(\uparrow\)
0,2 0,2
- Theo định luật bảo toàn khối lượng, khối lượng cốc đựng HCl tăng thêm:
11,2 - (0,2.2) = 10,8g
- Khi thêm Al vào cốc đựng dd H2SO4 có phản ứng:
2Al + 3 H2SO4 \(\rightarrow\) Al2 (SO4)3 + 3H2\(\uparrow\)
\(\dfrac{m}{27}\) mol \(\rightarrow\) \(\dfrac{3.m}{27.2}\)mol
- Khi cho m gam Al vào cốc B, cốc B tăng thêm m - \(\dfrac{3.m}{27.2}\)
- Để cân thăng bằng, khối lượng ở cốc đựng H2SO4 cũng phải tăng thêm 10,8g. Có: m - \(\dfrac{3.m}{27.2}.2\) = 10,8
- Giải được m = (g)
2.
PTPƯ: CuO + H2 \(\underrightarrow{400^oC}\) Cu + H2O
Nếu phản ứng xảy ra hoàn toàn, lượng Cu thu được \(\dfrac{20.64}{80}=16g\)
16,8 > 16 => CuO dư.
Hiện tượng PƯ: Chất rắn dạng bột CuO có màu đen dần dần chuyển sang màu đỏ (chưa hoàn toàn).
Đặt x là số mol CuO PƯ, ta có mCR sau PƯ = mCu + mCuO còn dư
= mCu + (mCuO ban đầu – mCuO PƯ)
64x + (20-80x) =16,8 \(\Leftrightarrow\) 16x = 3,2 \(\Leftrightarrow\) x= 0,2.
nH2 = nCuO= x= 0,2 mol. Vậy: VH2= 0,2.22,4= 4,48 lít
3.
2KClO3 \(\rightarrow\) 2KCl + 3O2
\(\dfrac{a}{122,5}\) \(\rightarrow\) \(\dfrac{a}{122,5}\left(74,5\right)\) + \(\dfrac{3a}{2}.22,4\)
2KMnO4 \(\rightarrow\) K2MnO4 + MnO2 + O2
\(\dfrac{b}{158}\) \(\rightarrow\) \(\dfrac{b}{2.158}197\) + \(\dfrac{b}{2.158}87\) + \(\dfrac{b}{2}22,4\)
\(\dfrac{a}{122,5}74,5=\dfrac{b}{2.158}197+\dfrac{b}{2.158}87\)
\(\dfrac{a}{b}=\dfrac{122,5\left(197+87\right)}{2.158.74,5}\approx1,78\)
\(\dfrac{3a}{2}.22,4:\dfrac{b}{2}.22,4=3\dfrac{a}{b}\approx4,43\)

Cho mình hỏi chút. Bài 1 sao C% = 2 vậy. Mình tưởng C%= 98 chứ nhỉ?

Bài 1 :
Độ tan của KNO3 ởi 20 độ C là :
\(S_{KNO_3\left(20^OC\right)}=\dfrac{60.100}{190}=\dfrac{6000}{190}\approx31,579\left(g\right)\)

Bài 7 :
\(SO_3+H_2O-->H_2SO_4\)
\(80g\)..............................................\(98g\)
\(40\left(kg\right)\)............................................\(x\left(kg\right)\)
\(m_{H_2SO_4}\left(li.thuyet\right)=\dfrac{40.98}{80}=49\left(kg\right)\)
Vì hiệu suất là 95% nên thực tế chỉ thu được :
\(49.95\%=46,55\left(kg\right)\)
Bài 8 :
PTHH : \(CaCO_3-t^0->CaO+CO_2\left(1\right)\)
Lượng đá vôi nguyên chất là :
\(1-10\%.1=0,9\left(tấn\right)=900\left(kg\right)=900000g\)
\(\left(1\right)=>n_{CaO}=n_{CaCO_3}=\dfrac{900000}{100}=9000\left(mol\right)\)
Vậy khối lượng vôi sống thu được là :
\(m_{CaO}=9000.56=504000\left(g\right)=0,504\left(tấn\right)\)





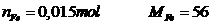


\(n_{Ba}=\dfrac{54,8}{137}=0,4\left(mol\right)\\ Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\\ n_B=n_{H_2}=n_{Ba}=0,4\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,4.22,4=8,96\left(l\right)\)