Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

là do dâu tằm để lâu ngày lên men sẽ có mùi rượu
sau đó mùi rượu sẽ ngày càng nặng lên phải ko cô?
PTHH
C6H12O6 -> 2C2H5OH + 2CO2
Em chưa học nhưng mà theo em trong dâu tằm có chứa glucozơ (C6H12O6) khi ngâm dâu với đường ở nhiệt độ thích hợp (30-35oC) thì hỗn hợp glucozo sẽ lên men chuyển dần thành rượu etylic nên có mùi của rượu ạ
\(PTHH:C_6H_{12}O_6\xrightarrow[30-35^oC]{men-ruou}2C_2H_5OH+2CO_2\)

Rượu cồn công nghiệp có hàm lượng methanol rất cao vượt mức cho phép nhiều lần. Mà khi đi vào cơ thể, methanol sẽ chuyển hóa thành các axit gây tổn thương cho các tế bào đặc biệt là ở mắt và não. Mà trên thực tế thì methanol không được phép có trong cơ thể. Còn rượu bình thường nếu được nấu đúng cách thì hàm lượng methanol sinh ra trong quá trình nấu là không đáng kể, không gây ra nguy hiểm( vẫn có trường hợp nguy hiểm vì uống quá nhiều).
Trả lời lại:
Rượu nếu được nấu đúng cách thì trong rượu hàm lượng etanol ở mức thấp có thể uống được. Còn cồn công nghiệp có hàm lượng etanol cao kèm theo đó còn có cả methanol là chất độc nên cồn công nghiệp không thể uống được.

- Lớp cặn này là do calcium bicarbonate hoặc magnesium bicarbonate tan trong nước, nhờ nhiệt độ sinh ra calcium carbonate hoặc magnesium hydroxide lắng xuống đáy cùng một số tạp chất.
- Phương pháp loại bỏ lớp cặn ở đáy ấm:
+ Giấm hoặc chanh: thành phần chủ yếu của cặn nước là calcium carbonate, sẽ phản ứng với axetic acid trong giấm, tạo thành các chất khoáng tan được trong nước và khí CO2. Đổ giấm 10% vào trong ấm đun nước, sau đó thêm nước, đun sôi để nguội 1 tiếng, sau đó rửa lại là ấm lại sáng bóng như mới.
+ Baking soda: Hầu hết các ấm đun nước đều làm bằng nhôm, vì vậy, có thể bỏ một thìa nhỏ baking soda vào, đun sôi lên vài phút là cặn có thể được loại bỏ. Hoặc cũng có thể đổ baking soda có độ đặc 1%, thêm 500ml nước, lau nhẹ đáy ấm là sạch.
Lớp cặn này là do calcium bicarbonate hoặc magnesium bicarbonate tan trong nước, nhờ nhiệt độ sinh ra calcium carbonate hoặc magnesium hydroxide lắng xuống đáy cùng một số tạp chất.
+ Khoai sọ: Khi mới mua ấm siêu tốc về, nên cho vỏ khoai sọ vào ấm, thêm đầy nước và nấu khoảng 30 phút. Làm như vậy, sau này khi đun nước sẽ không còn bị cặn nữa. Đối với ấm siêu tốc cũ đã tích cặn thì cũng có thể áp dụng cách này để lấy đi lớp cặn trong ấm.
Giấm hoặc chanh: Đây là cách đơn giản và hiệu quả nhất. Mọi người đều biết thành phần chủ yếu của cặn nước là calcium carbonate, sẽ phản ứng với axetic acid trong giấm, tạo thành các chất khoáng tan được trong nước và khí CO2. Đổ giấm 10% vào trong ấm đun nước, sau đó thêm nước, đun sôi để nguội 1 tiếng, sau đó rửa lại là ấm lại sáng bóng như mới....

Không giống như nhiều loại hoa khác, hoa cẩm tú cầu có thể thay đổi màu sắc. Ngay từ thế kỹ 18, những người làm vườn đã nhận thấy điều này, và đã thử nghiệm bằng cách chôn gỉ sắt, đổ bã chè thậm chí là niệm thần chú xung quanh cây ^^. Trong bài viết này, Nhà Nông Việt sẽ hướng dẫn các bạn cách đổi màu cho cẩm tú, lý giải tại sao cây cẩm tú cầu của bạn lá xanh tốt nhưng không hoa, và cách sử dụng phân bón cho cẩm tú cầu.
 hoa cẩm tú cầu
hoa cẩm tú cầu
1. Cách đổi màu cho cẩm tú cầuCẩm tú cầu tùy theo giống mà có khả năng đổi màu. Ở Việt Nam, phổ biến nhất là cầm tú cầu đổi màu từ trắng, sang xanh blue, tím hồng, hồng, rồi hoa tàn. Cẩm tú cầu có đổi màu được như vậy là phụ thuộc vào độ Ph của đất. Nói chung, đất chua, có độ pH thấp hơn 6.0, hoa cẩm tú cầu mới có hoa mầu xanh blue. Đất phèn, với độ pH trên 7.0, thúc đẩy cây ra màu hồng và màu đỏ. Với độ pH giữa 6 và 7, cây cho ra những bông hoa hồng tím.Để giảm độ pH của đất (tức là muốn cẩm tú cầu ra hoa màu xanh blue),bạn nên thêm thêm lưu huỳnh hoặc nhôm,dung dịch clorua sắt hay có thể chôn vài cây đinh gỉ vào gốc cây hoặc cũng có thể chôn vào đất một ít giấy nhôm dùng để nướng đồ ăn. Muốn hoa có màu hồng tím có thể bón vào đất một ít vôi bột.Note: Kiểm tra độ PH bằng cách, mua một ít giấy quỳ thí nghiệm.
 một chậu hoa cẩm tú cầu tại Vườn
một chậu hoa cẩm tú cầu tại Vườn
2.Tại sao cây cẩm tú cầu nhà mình rất tốt mà không ra hoa :(:(Đầu tiên bạn nên nhớ là không bao giờ cắt tỉa cành cẩm tú cầu trừ các trường hợp sau:-các thân cành đã chết, thối.- cây ít nhất 5 năm tuổi. Việc cắt tỉa là cần thiết để cây tái sinh.-khi cây phát triển quá xum xuê, rậm rạp, cành nọ chồng cành kia ảnh hưởng đến sự phát triển của cây.


Điều thứ 2: Việc cắt tỉa nên khi nào?Cẩm tú cầu ra hoa vào cuối xuân-đầu hè năm sau (tức là khoảng tháng 4). Nếu muốn cắt tỉa cành thì phải thực hiện từ sau khi hoa tàn, hết tháng tư và muộn nhất là giữa tháng 7. Nếu bạn cắt sau thời điểm này, thì năm sau cẩm tú cầu sẽ không cho hoa ở những cành mới. Để ý kỹ nhé, bạn sẽ thấy những cành cẩm tú cầu mơn mởn xanh tốt nhưng không cho ra hoa, còn những cành có thân gỗ màu nâu lại có những nụ hoa bé bé úp giữa hai lá non. Bạn phải ghi nhỡ kỹ điều này nếu muốn mỗi cành cẩm tú cầu là một bông hoa vào mùa hè năm sau.3.Sau khi cắt tỉa, nên làm gì?Chế độ phân bón: Cẩm tú cầu nên được bón phân vi sinh. Định kỳ 20 ngày một lần. Phân vi sinh Quế Lâm, 20 ngày bón 1 lần. Phân bò Tribat bổ sung vào đất, xới tới lớp đất mặt và trộn đều. 1 tháng dùng 1 lần. Sau khi cắt tỉa nên bón thêm đạm, 1 tuần phun một lần cho cây mau ra rễ, mập chồi, rễ đâm mạnh. Sử dụng phân bón lá Đầu trâu 501Chế độ nước tưới: Mùa hè tưới 2 lần, mùa đông tưới 1 lần.Chế độ ánh sáng: Sử dụng dàn có mái chè, ánh nắng lốm đốm vào mùa hè, cẩm tú cầu không chịu được nắng gắt vào mùa hè, nhanh héo rũ.Sản phẩm có sử dụng trong bài viết:-Phân vi sinh Quế Lâm: 20/túi- loại 2 kg. Trộn cùng đất.-Phân bò Tribat: 25k/túi-loại 3dm3. Trộn cùng đất-Đầu trâu 501: 30k/lọ- 100gr. 1 gr pha được 1 lít nước. Hòa nước tưới lên lá cho cây.Cuối cùng, một mách nhỏ cho các bạn, rễ cẩm tú cầu có xu hướng đâm mạnh ra bên ngoài. Bạn nên chuẩn bị một chậu có lỗ đục hơi to một chút, hạn chế di chuyển vị trí cây. Nếu thỉnh thoảng bạn có bỏ quên cây thì khi nhấc chậu lên bạn sẽ thấy rễ cây mọc rất tốt, đâm xuyên qua phần lỗ chậu đục. Như vậy cây sẽ tận dụng được nguồn dinh dưỡng bên ngoài, bộ rễ phát triển tốt.Chúc các bạn chăm cây thành công ^^
Theo nhiều chuyên gia cây cảnh, hoa cẩm tú cầu là loài cây đặc biệt, có thể sống trên đất chua, trung tính hoặc có tính vôi. Không những thế, màu sắc của hoa có thể thay đổi tuỳ theo độ pH trong đất. Ở đất chua cây sẽ cho hoa màu lam, đất trung tính hoa Cẩm tú cầu có màu trắng sữa, đất có độ pH > 7 hoa có màu tím hoặc hồng. Tùy theo sở thích của người chơi mà ta trồng ở đất có độ pH khác nhau.
Cụ thể, nếu bạn muốn hoa màu xanh cần trồng trên đất chua (độ pH =< 5). Để tăng độ acid bón aluminum sulfate vào các tháng đầu hè như tháng 3,4. Mùa Thu vào tháng 8,9 và 10. Nếu đảm bảo được yếu tố trên thì cây cho ra hoa màu hoa cà, màu hồng sẽ biến thành màu xanh.
Đất có tính vôi (7.5=< độ pH <10) hoa có màu hoa cà, hồng hoặc đỏ. Vào mùa xuân tưới thêm calcium carbonate /vôi thì hoa màu xanh sẽ trở nên hồng. Tro trấu cũng có tác dụng tăng tính kiềm của đất (trong tro trấu có chứa Kali). Đất trung tính có độ pH =7 hoa có màu trắng sữa. Hoa ban công có màu trắng, thì có làm biến đổi độ pH của đất hoa vẫn không đổi mà

a) Sơ đồ phản ứng:
S → SO2 → SO3 → H2SO4 → Na2SO4 → BaSO4.
b) Phương trình phản ứng:

\(n_{MgCO3}=\dfrac{8,4}{84}=0,1\left(mol\right)\)
a) Pt : \(2CH_3COOH+MgCO_3\rightarrow\left(CH_3COO\right)_2Mg+CO_2+H_2O|\)
2 1 1 1 1
0,2 0,1 0,1 0,1
b) \(n_{CH3COOH}=\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
⇒ \(m_{CH3COOH}=0,2.60=12\left(g\right)\)
\(C_{ddCH3COOH}=\dfrac{12.100}{200}=6\)0/0
\(n_{\left(CH3COO\right)2Mg}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ \(m_{\left(CH3COO\right)2Mg}=0,1.142=14,2\left(g\right)\)
\(m_{ddspu}=8,4+200-\left(0,1.44\right)=204\left(g\right)\)
\(C_{dd\left(CH3COO\right)2Mg}=\dfrac{14,2.100}{204}=6,96\)0/0
Chúc bạn học tốt

A : CuO
B : C
C : CO2
D : Ca(OH)2
PTHH: 2CuO + C ---to→ 2Cu + CO2
CO2 + Ca(OH)2 → CaCO3 + H2O
A là CuO
B là C (trong dạng than)
C là CO2 và có CO
D là NaOH
PTHH: CuO+C=>Cu+CO2+CO
NaOH+CO2=>NaHCO3+H2O
NaOH+CO2=>Na2Co3+H2O

a. PTHH: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
b. Có \(n_{Mg}=\frac{3,6}{24}=0,15mol\)
\(140ml=0,14l\)
\(n_{H_2SO_4}=0,14.1,2=0,168mol\)
Lập tỉ lệ \(\frac{n_{Mg}}{1}< \frac{n_{H_2SO_4}}{1}\)
Vậy Mg đủ, \(H_2SO_4\) dư
Theo phương trình \(n_{H_2SO_4}=n_{Mg}=0,15mol\)
\(\rightarrow n_{H_2SO_4\left(\text{(dư)}\right)}=0,168-0,15=0,018mol\)
\(\rightarrow m_{H_2SO_4\left(\text{(dư)}\right)}n.M=0,018.98=1,764g\)
c. MgSO\(_4\) là muối
Theo phương trình \(n_{MgSO_4}=n_{Mg}=0,15mol\)
\(\rightarrow m_{\text{muối}}=m_{MgSO_4}=n.M=0,15.120=18g\)
d. \(H_2\) là khí
Theo phương trình \(n_{H_2}=n_{Mg}=0,15mol\)
\(\rightarrow V_{H_2\left(ĐKTC\right)}=n.22,4=0,15.22,4=3,36l\)






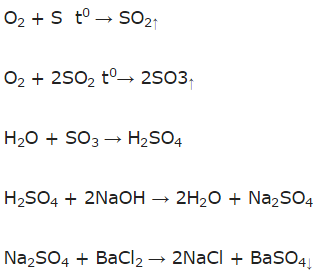

Thành phần chính của thuốc muối là natri hiđrôcacbonat, CTHH: NaHCO3. Trong dạ dày thường chứa dung dịch axit. Người bị đau dạ dày là người có nồng độ dung dịch axit HCl cao làm dạ dày bị bào mòn. NaHCO3 dùng để làm thuốc trị đau dạ dày vì nó làm giảm hàm lượng dung dịch HCl có trong dạ dày nhờ có phản ứng hóa học.
NaHCO3 + HCl → NaCl + CO2 + H2O
Thành phần chính của thuốc muối nabica là natri hidrocacbonat (NaHCO3).
Cơ chế hoạt động của thuốc: Trong dạ dày có 1 lượng axit HCl giúp hòa tan các loại muối khó tan trong quá trình ăn uống. Khi axit dạ dày tăng cao, nếu uống thuốc muối nabica thì NaHCO3 trong thuốc muối tác dụng với axit HCl trong dạ dày theo phương trình hóa học:
NaHCO3 + HCl \(\rightarrow\) NaCl + CO2\(\uparrow\) + H2O.
Lượng axit thừa trong dạ dày đã tác dụng với NaHCO3 có trong thuốc muối nabica, do vậy không còn, nhờ vậy người bị ợ chua, thừa axit không còn bị như vậy nữa.