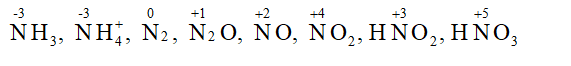Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

80 HNO3 + 31Zn ----> 31Zn(NO3)2 + 40H2O + NO + NO2 + 6N2O

1/\(4Mg+5H_2SO_4đ\) ➞ 4H2O +H2S+4MgSO4
2/\(Al_2O_3\)+\(H_2SO_4đ\) ➞ \(Al_2\left(SO_4\right)_3\)+H2O
3/\(10HNO_3+3Fe\left(OH\right)_2\)➜ \(8H_2O+NO\)↑ +\(3Fe\left(NO_3\right)_3\)

1.
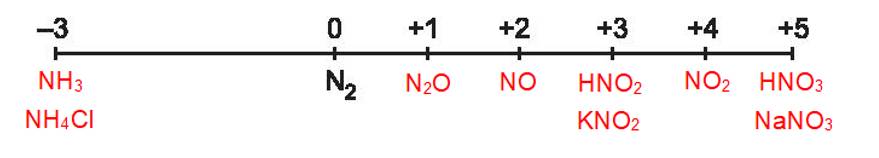
2. Khi tham gia phản ứng oxi hoá – khử, số oxi hoá của nitrogen có thể giảm hoặc tăng, do đó nitrogen thể hiện tính oxi hoá hoặc tính khử. Một số quá trình minh hoạ:
Quá trình oxi hoá: \(\mathop {{{\rm{N}}_{\rm{2}}}}\limits^{\rm{0}} \to {\rm{2}}\mathop {\rm{N}}\limits^{{\rm{ + 2}}} {\rm{ + 4e}}\)
Quá trình khử: \(\mathop {{{\rm{N}}_{\rm{2}}}}\limits^{\rm{0}} + {\rm{6e}} \to {\rm{2}}\mathop {\rm{N}}\limits^{ - 3} \)

1) Cu(OH)2 + Na2SO4 --> X
2) CaCO3 + NaCl ---> X
3) 2KOH + Cu(NO3)2 ---> 2KNO3 + Cu(OH)2
4) Al(NO3)3 + (NH4)2SO4 ---> X
5) Cu + H2O --> X
6) KCl + Ba(NO3)2 ---> X
7) BaCl2 + Mg(NO3)2 ---> X
8) Cu(OH)2 + NaCl --> X
9) BaCl2 + Mg(NO3)2 ---> X
10) MgSO4 + HNO3 ---> X
11) FeCl2 + Al(NO3)3 ---> X
12) KOH + BaCl2 ---> X

Cu khong tác dụng với HCl nên phần 1 chỉ có Fe tác dụng được
nH2 =2,24/22,4 =0,1(mol)
bảo toàn e, ta có:
2*nH2 =3*nFe =>nFe =1/15 (mol)
=>mFe =(1/15)*56 =56/15 (1)
Fe bị thụ động hóa với HNO3 đặc nguội nên phần 2 chỉ có Cu tác dụng được
nNO2 =3,36/22,4 =0,15 (mol)
bảo toàn e, ta có:
nNO2 =2*nCu =>nCu =0,05 (mol)
=>mCu =0,05*64=3,2 (2)
Từ (1) và (2): =>m=6,9( giá trị xấp xỉ)
Gọi số mol của NO và NO2 lần lượt là x và y
nhỗn hợp khí =4,48/22,4=0,2(mol) hay x+y=0,2 (1)
từ tỉ khối ta có được sơ đồ đường chéo và từ đó suy ra được tỉ lệ số mol là
x=y (2)
giải hệ phương trình (1) và (2)=>x=y=0,1(mol)
nHNO3 phản ứng =4*nNO +2*nNO2 =0,6 (mol)
=>VHNO3 =0,6/2=0,3