Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt nZn = x mol; nFe = y mol.
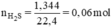
Ta có hệ phương trình: 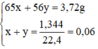
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Theo đề bài ta có bột S dư nên Fe, Zn tác dụng hết với S.
a)Phương trình hóa học của phản ứng.
Zn + S -> ZnS Fe + S -> FeS
x mol x mol y mol y mol
ZnSO4 + H2SO4 -> ZnSO4 + H2S
x mol x mol
FeSO4 + H2SO4 -> FeSO4 + H2S
x mol y mol
Ta có hệ phương trình :
Giải hệ phương trình => x = 0,04 (mol), y = 0,02 (mol).
Vậy mZn = 0,04.65 = 2,6g
mFe = 0,02.56 = 1,12g.

a)Phương trình:
Zn+S→ZnS; Fe+S→FeS
ZnS+H2SO4→ZnSO4+H2S
FeS+H2SO4→FeSO4+H2S
b)Gọi m, m' là khối lượng Zn, Fe trong hỗn hợp ban đầu
m+m' = 3,72
nH2S=nZnS+nFeS=nZn+nFe=m/65+m'/56
=1,344/22,4=0,06
Bấm máy giải hệ phương trình:
m+m' = 3,72
(1/65).m+(1/56).m' = 0,06
ta được nghiệm: m = 2,6 ; m' = 1,12VV

Các PTHH:
Fe + S → FeS (1)
FeS + 2HCl → Fe Cl 2 + H 2 S (2)
Fe(dư) + 2HCl → Fe Cl 2 + H 2 (3)
HCl (dư) + NaOH → NaCl + H 2 O (4)
Nồng độ mol của dung dịch HCL :
Tổng số mol HCL tham gia các phản ứng (2), (3), (4) :
0,1 + 0,1 + 0,0125 = 0,2125 (mol)
Nồng độ mol của dung dịch HCl : 0,2125/0,5 = 0,425 (mol/l)

a) PTHH: Fe + S --to--> FeS
Zn + S --to--> ZnS
FeS + 2HCl --> FeCl2 + H2S
ZnS + 2HCl --> ZnCl2 + H2S
Fe + 2HCl --> FeCl2 + H2
Zn + 2HCl --> ZnCl2 + H2
b)
Gọi số mol Zn, Fe là a, b (mol)
=> 65a + 56b = 3,72 (1)
Theo PTHH: \(a+b=n_{khí}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\) (2)
(1)(2) => a = 0,04 (mol); b = 0,02 (mol)
=> \(\left\{{}\begin{matrix}m_{Zn}=0,04.65=2,6\left(g\right)\\m_{Fe}=0,02.56=1,12\left(g\right)\end{matrix}\right.\)
c) \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{2,6}{3,72}.100\%=69,9\%\\\%m_{Fe}=\dfrac{1,12}{3,72}.100\%=30,1\%\end{matrix}\right.\)
Gọi \(\left\{{}\begin{matrix}n_{Zn}=x\\n_{Fe}=y\end{matrix}\right.\)
\(Zn+S\rightarrow\left(t^o\right)ZnS\)
x x x ( mol )
\(Fe+S\rightarrow\left(t^o\right)FeS\)
y y y ( mol )
\(n_{H_2S}=\dfrac{1,344}{22,4}=0,06mol\)
\(ZnS+2HCl\rightarrow ZnCl_2+H_2S\)
x x ( mol )
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
y y ( mol )
Ta có:
\(\left\{{}\begin{matrix}97x+88y=3,72+32\left(x+y\right)\\x+y=0,06\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}97x+88y=5,64\\x+y=0,06\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,04\\y=0,02\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Zn}=0,04.65=2,6g\\m_{Fe}=0,02.56=1,12g\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{2,6}{3,72}.100=69,89\%\\\%m_{Fe}=100\%-69,89\%=30,11\%\end{matrix}\right.\)

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
Phương trình hóa học của phản ứng:
Zn + S → ZnS
Fe + S → FeS
ZnS + H2SO4 → ZnSO4 + H2S
FeS + H2SO4 → H2S + FeSO4

Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{1,33}{22,4}=0,059375\left(mol\right)\)
PTHH:
Zn + 2HCl ---> ZnCl2 + H2
a a
Fe + 2HCl ---> FeCl2 + H2
b b
Hệ pt \(\left\{{}\begin{matrix}65a+56b=3,73\\a+b=0,059375\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,045\left(mol\right)\\b=0,014375\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Zn}=0,045.65=2.925\left(g\right)\\m_{Fe}=0,014375.56=0,805\left(g\right)\end{matrix}\right.\\ \rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{2,925}{3,73}=78,42\%\\\%m_{Fe}=100\%-78,42\%=21,58\%\end{matrix}\right.\)

a.
Do E gồm hai oxit nên Mg, CuCl2 hết, Fe đã phản ứng
Phương trình
Mg + CuCl2 \(\rightarrow\) MgCl2 + Cu (1)
Fe + CuCl2 \(\rightarrow\) FeCl2 + Cu (2)
Khi cho NaOH dư vào
2NaOH + MgCl2 \(\rightarrow\) Mg(OH)2 + 2NaCl (3)
2NaOH + FeCl2 \(\rightarrow\) Fe(OH)2 + 2NaCl (4)
Khi nung
Mg(OH)2 \(\underrightarrow{t^o}\) MgO + H2O (5)
4Fe(OH)2 +O2 \(\underrightarrow{t^o}\) 4Fe2O3 + 4H2O (6)
b.
Đặt số mol của Fe, Mg có ban đầu lần lượt là x, y, số mol Fe dư là t (x, y>0, t\(\ge\)0)
Có hệ \(\begin{cases}24x+56y+0t=3,16\\40x+64y-8t=3,84\\40x+80y-80t=1,4\end{cases}\)\(\Rightarrow\)\(\begin{cases}x=0,015mol\\y=0,05mol\\t=0,04mol\end{cases}\)
Vậy trong hỗn hợp đầu %mMg = \(\frac{0,015.24}{3,16}.100\)=11,392%
%mFe=100%-11,392% = 88,608%
Nồng độ của CuCl2: z =0,025:0,25=0,1M

\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_S=\dfrac{1,6}{32}=0,05\left(mol\right)\)
PTHH: Fe + S -----to ------> FeS
Theo đề: 0,1....0,05 (mol)
Lập tỉ lệ : \(\dfrac{0,1}{1}>\dfrac{0,05}{1}\) => Sau phản ứng Fe dư
=> \(n_{Fe\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\)
\(n_{FeS}=n_S=0,05\left(mol\right)\)
Fe + 2HCl → FeCl2 + H2
0,05----------------------->0,05
FeS + 2HCl → FeCl2 + H2S
0,05-------------------------->0,05
% về thể tích các khí trong B cũng là % về số mol
\(\%V_{H_2}=\dfrac{0,05}{0,05+0,05}=50\%\)
=> %V H2S = 100 - 50 = 50%

nFe= 5.6/56= 0.1 mol
nS= 1.6/32=0.05 mol
Fe + S -to-> FeS
0.05__0.05____0.05
hh X gồm: 0.05 mol Fe dư
0.05 mol FeS
Fe + 2HCl --> FeCl2 + H2 (1)
0.05__0.1____0.05___0.05
FeS + 2HCl --> FeCl2 + H2S (2)
0.05__0.1_____0.05____0.05
Hỗn hợp khí: 0.05 mol H2
0.05 mol H2S
dd A: 0.1 mol FeCl2 , HCl dư
Vì: %thể tích tương ứng với % số mol nên:
%VH2=%VH2= 0.05/0.1 *100= 50%
nNaOH= 0.125*0.1=0.0125 mol
NaOH + HCl --> NaCl + H2O(3)
0.0125___0.0125
nHCl (1,2,3)= 0.1+0.1+0.0125=0.2125 mol
CM HCl = 0.2125/0.5=0.425M
2/ Đặt: nMg= x mol
nFe= y mol
Mg + S -to-> MgS
x___________x
Fe + S -to-> FeS
y__________y
mhh= 24x + 56y = 2.4 g (1)
MgS + H2SO4 --> MgSO4 + H2S
x________________________x
FeS + H2SO4 --> FeSO4 + H2S
y_______________________y
nH2S= x + y = 1.344/22.4=0.06 mol (2)
Giải (1) và (2):
x= y= 0.03
mMg= 0.03*24=0.72g
mFe= 0.03*56=1.68g