Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
![]()
· Phần 1 + NaOH → 0,75 mol H2
=> Al dư, Fe2O3 phản ứng hết.
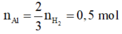
· Đặt số mol Fe, A l 2 O 3 trong phần 1 lần lượt là 2x, x.
Giả sử phần 2 có khối lượng gấp k lần phần 1.
![]() (1)
(1)
Phần 2:
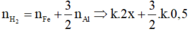
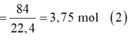
· Từ (1) và (2) suy ra:
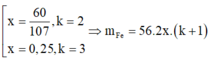
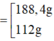
Kết hợp đáp án suy ra m F e = 112 g

- TN1: nH2 = 0,07875 mol => nAl dư = 0,07875.2/3 = 0,0525 mol.
nH2 do pư với HCl = 1,512/ 22,4 = 0,0675 mol => nFe = 0,0675 mol.
- TN2: gọi số mol Al dư là 0,0525x và số mol Fe là 0,0675x (x là tỷ lệ khối lượng giữa phần 1 và phần 2)
=> 0,0525x. 3/2 + 0,0675x = 9,828/22,4 => x = 3
Vậy trong hỗn hợp Y có nAl dư = 0,0525. 4 = 0,21 mol. nFe = 0,0675. 4= 0,27 mol.
pư: 8Al + 3Fe3O4 ---> 4Al2O3 + 9Fe
0,24 <------0,09 <-----------------0,27 mol
=> Hỗn hợp đầu có 0,24+ 0,21 = 0,45 mo, Al và 0,09 mol oxit sắt từ.
=> m = 0,45. 27 + 0,09. 232 = 33,03g

Bạn bấn vào đây, có người hỏi bài này rồi nhá Câu hỏi của Mạc Nhược Ca - Hóa học lớp 12 | Học trực tuyến

Tham Khảo
HD • Nhiệt nhôm Al, FexOy → 92,35 gam rắn Y: Al2O3; Fe; có thể có Al hoặc oxit sắt dư
Rắn Y + NaOHdư → 0,375 mol H2 + rắn Z
→ Al dư; FexOy hết
1/2Z + H2SO4 đặc → 0,6 mol SO2
• 2Aldư + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
nAldư = 2/3 × nH2 = 2/3 × 0,375 = 0,25 mol → mAldư = 0,25 × 27 = 6,75 gam.
• Fe + H2SO3 → SO2
Theo bảo toàn electron 3 × nFe = 2 × nSO2 → nFe = 2/3 × nSO2 = 2/3 × 0,6 = 0,4 mol
→ mFe = 0,4 × 56 = 22,4 gam
• mY = mAl2O3 + mFe + mAl dư → mAl2O3 = 92,35 - 6,75 - 22,4 × 2 = 40,8 gam
→ nAl2O3 = 40,8 : 102 = 0,4 mol.
nO =0.4 .3 = 1.2 mol ==> x/y = nFe/ nO =2/3
CT: Fe2O3
Bạn tham khảo https://moon.vn/hoi-dap/thuc-hien-phan-ung-nhiet-nhom-hon-hop-x-gom-al-va-mot-oxit-sat-fexoy-trong-dieu-kien-358530

Đáp án A
Hỗn hợp rắn gồm Al, Al2O3, Fe với n Fe = 2 n Al 2 O 3 . Chia thành 2 phần không bằng nhau:
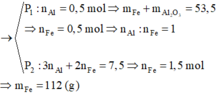

nO2=7.36-5.6 /32 = 0.055.
dB/H2= 19 --> nNO=nNO2=a(mol)
BT e : 3nFe= 4nO2 + 3nNO + nNO2
<=> 0.3= 0.22 + 4a
=> a= 0.04 --> V= 0.896 l

Chọn A.
Zn + 2H+ → Zn2+ + H2
Fe + 2H+ → Fe2+ + H2
= 0,04 (mol)
Gọi x và y là số mol của Zn và Fe
Ta có hệ phương trình:
=> x = 0,01; y = 0,03
%mZn = .100% = 27,9%; %mFe = 72,1%
Ngân 2,33 gam hợp kim Fe-Zn trong lượng dư dung dịch HCl đến khi phản ứng xẩy ra hoàn toàn thấy giải phóng 896 ml khí H2 (đktc). Thành phần phần trăm về khối lượng của hợp kim này là
A. 27,9% Zn và 72,1% Fe
B. 26,9% Zn và 73,1% Fe
C. 25,9% Zn và 74,1% Fe
D. 24,9% Zn và 75,1% Fe
Fe2O3 + 2Al -to-> 2Fe + Al2O3
nH2 (1) = 0.75 mol
nH2 (2) = 3.75 mol
Vì : Phần (1) + NaOH --> H2
=> Al dư
Đặt :
nFe2O3 = x mol
2Al + Fe2O3 -to-> Al2O3 + 2Fe
2x_____x__________x_____2x
P1 :
NaOH + Al + H2O --> NaAlO2 + 3/2H2
_______0.5____________________0.75
P2:
Đặt :
nFe = 2kx mol
nAl dư = 0.5k mol
nAl2O3 = kx mol
Fe + 2HCl --> FeCl2 + H2
2kx________________2kx
2Al + 6HCl --> 2AlCl3 + 3H2
0.5k__________________0.75k
<=> k ( 2x + 0.75 ) = 3.75
=> k = 3.75/(2x + 0.75 )
mP2 - mP1 = 134
<=> 56*2kx + 0.5k*27 + 102kx - ( 2x*56 + 27*0.5 + 102x) = 134
<=> 112kx + 13.5k + 102kx - 112x - 13.5 - 102x = 134
<=> 214kx + 13.5k - 214x = 147.5
<=> 214x( k - 1 ) + 13.5k = 147.5
<=> 214x [3.75/(2x + 0.75) - 1 ) + 13.5[3.75/(2x + 0.75)] = 147.5
<=> x = 60/107
Tới đây thì em tự thế số mol vào tính nhé
Dạ , e cảm ơn