Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có
\(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\\ \Rightarrow p_2=\dfrac{10^5.450}{300}=15.10^4Pa\)

Ta có : T1 = toC + 273 = 30 + 273 = 303oK
p1 = 2 bar = 2 . 105 Pa
p2 = 4 bar = 4 . 105
Vì quá trình là đẳng tích , áp dụng định luật Charles ta có
\(\frac{p_1}{p_2}=\frac{T_1}{T_2}\)→ T2 = \(\frac{p_2.T_1}{p_1}=\frac{4.10^5.303}{2.10^5}\)= 606oK
Vậy để áp suất tăng lên gấp đôi , ta phải tăng nhiệt độ lên 606oK
* Trạng thái 1: T1 = 273 + 30 = 303 K
p1 = 2 bar
* Trạng thái 2: T2 = ? p2 = 2p1
* Vì thể tích bình không đổi nên:
\(\frac{P1}{T1}=\frac{P2}{T2}\Rightarrow T2=\frac{P2.T1}{P1}=\frac{2P1.T1}{P1}\) = 2T1 = 606 K

Xét lượng khí trong bình.
Trạng thái đầu: V 1 = 8 lít; T 1 = 100 + 273 = 373 K ; p 1 = 10 5 N/ m 2
Trạng thái cuối: V 2 = 8 lít; T 2 = 20 + 273 = 293 K; p 2 = ?
Vì thể tích không đổi nên:
p 1 / T 1 = p 2 / T 2 ⇒ p 2 = p 1 T 2 / T 1 = 7,86. 10 4 N/ m 2

Xét lượng khí còn lại trong bình
Trạng thái 1: V 1 = V/2; T 1 = 27 + 273 = 300 K; p 1 = 40 atm.
Trạng thái 2: V 2 = V; T 2 = 12 + 273 = 285 K; p 2 = ? atm,
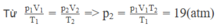

Khi khí chưa thoát ra ngoài ta có: p 1 V 1 = m 1 μ R T 1 (1)
Khi một nửa lượng khí đã thoát ra ngoài ta có:
p 2 V 2 = m 2 μ R T 2 với V1 và m 2 = m 1 2 ⇒ p 2 V 1 = m 1 2 μ R T 2
Từ (1) và (2) ⇒ p 2 = p 1 T 2 2 T 1 = 40.285 2.300 = 19 a t m

Cần tác dụng vào nắp một lực thằng được trọng lượng của nắp và lực gây ra bởi sự chênh lệch áp suất giữa không khí bên ngoài và bên trong bình:
F = mg + S( p 1 - p 2 ) = mg + π d 2 /4( p 1 - p 2 ) = 692N

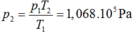
Quá trình đẳng tích:
\(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow\dfrac{10^5}{293}=\dfrac{p_2}{313}\)
\(\Rightarrow p_2=110238Pa\)