Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

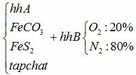
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
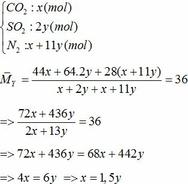
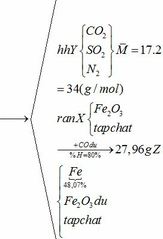
Khối lượng Fe có trong Z là:
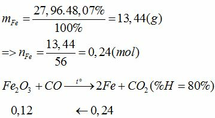
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
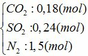
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
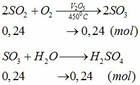
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
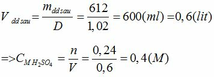

mCaCO3 = 500*80%= 400 (g)
nCaCO3 = 400/100 = 4 (mol)
nCaCO3(pư) = 4*70%=2.8 (mol)
CaCO3 -to-> CaO + CO2
2.8..................2.8
Chất rắn X : CaCO3 dư , CaO
mX = ( 4 -2.8 ) *100 + 2.8*56 = 276.8 (g)
%CaO = 2.8*56/276.8 * 100% = 56.64%
a)mCaCO3=500.80%=400(g) -> nCaCO3=400/100=4(mol)
PTHH: CaCO3 -to-> CaO + H2O
nCaO(LT)=nCaCO3=4(mol)
=> nCaO(TT)=4. 70%=2,8(mol)
=>mX=mCaO+ m(trơ)+ mCaCO3(chưa p.ứ)=2,8.56+100+ 1,2.100=376,8(g)
b) %mCaO= (156,8/376,8).100=41,614%

a. Các phương trình có thể xảy ra:
C + O2 → t ∘ CO2 (1)
CaCO3 → t ∘ CaO + CO2 (2)
MgCO3 → t ∘ MgO + CO2 (3)
CuCO3 → t ∘ CuO + CO2 (4)
C +CO2 → t ∘ 2CO (5)
C + 2CuO → t ∘ 2Cu + CO2 (6)
CO + CuO → t ∘ Cu + CO2 (7)
CaO + 2HCl →CaCl2 + H2O (8)
MgO + 2HCl →MgCl2 + H2O (9)
CuO + 2HCl →CuCl2 + H2O (10)
b. Vì sau phản ứng có CO và CO2, các phản ứng xảy ra hoàn toàn nên các chất còn lại sau khi nung là CaO, MgO và Cu không có phản ứng (10)
mCu = 3,2(g) => mCuCO3 = 6,2g
Gọi số mol CaCO3, MgCO3, C trong hỗn hợp lần lượt là a, b, c.(*)
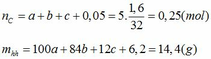
Giải ( *), (**), (***) ta được a=0,025; b=0,05; c=0,125.
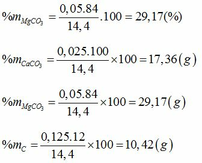

b.
4P + 5O2 → 2P2O5
0,16→ 0,2
Dư: 0,025
Sau pứ m(bình 1) = mP2O5 = 11,36 (g)
O2 + 2C → 2CO
0,025→ 0,05 0,05
Dư: 0,25
Sau pứ m(bình 2) = mCdư = 3 (g)

Chất rắn ko tan là Cu
Đặt \(n_{Mg}=x(mol);n_{Al}=y(mol)\Rightarrow 24x+27y=13-4=9(1)\)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45(mol)\\ PTHH:Mg+2HCl\to MgCl_2+H_2\\ 2Al+6HCl\to 2AlCl_3+3H_2\\ \Rightarrow x+1,5y=0,45(2)\\ (1)(2)\Rightarrow x=0,15(mol);y=0,2(mol)\\ a,\%_{Cu}=\dfrac{4}{13}.100\%=30,77\%\\ \%_{Mg}=\dfrac{0,15.24}{13}.100\%=27,69\%\\ \%_{Al}=100\%-30,77\%-27,69\%=41,54\%\\ b,\Sigma n_{HCl}=2x+3y=0,9(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,9}{2}=0,45(l)\)

2Al + 6HCl → 2 A l C l 3 + 3 H 2
a……….3/2.a (mol)
Mg + 2HCl → M g C l 2 + H 2
b....................b (mol)
4 gam rắn không tan là Cu, gọi số mol của Al và Mg lần lượt là a và b (mol). Ta có:
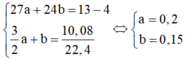
⇒ % m C u = 4 13 .100 = 30,77 % ⇒ % m A l = 0,2.27 13 .100 = 41,54 % ⇒ % m M g = 100 % − 30,77 % − 41,54 % = 27,69 %
⇒ Chọn C.
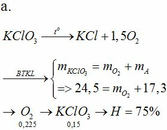
a. PTHH: \(2KClO_3\rightarrow^{t^o}2KCl+3O_2\uparrow\)
Vậy A gồm \(KClO_3\) dư và KCl
\(n_{O_2}=\frac{10,08}{22,4}=0,45mol\)
Theo phương trình \(n_{KClO_3}=n_{KCl}=\frac{2}{3}n_{O_2}=0,3mol\)
\(\rightarrow m_{KCl}=0,3.74,5=22,35g\)
\(\rightarrow m_{KClO_3\left(\text{dư}\right)}=45-22,35=22,65g\)
Có \(m_{KClO_3\left(\text{p/ứ}\right)}=0,3.122,5=36,75g\)
\(\rightarrow H\%=\frac{36,75}{36,75+22,65}.100\%\approx61,87\%\)
b. \(\%m_{KCl\left(trongA\right)}=\frac{22,35}{22,35+22,65}.100\%=49,67\%\)
\(\%m_{KClO_3\left(trongA\right)}=100\%-49,67\%=50,33\%\)