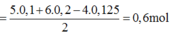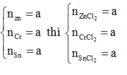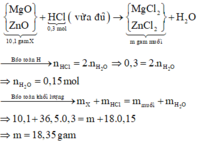Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH2= 0,35(mol)
a) PTHH: Mg + 2 HCl -> MgCl2 + H2
x_________2x_______x______x(mol)
PTHH: Fe + 2 HCl -> FeCl2 + H2
y________2y________y_____y(mol)
Ta có hpt: \(\left\{{}\begin{matrix}24x+56y=13,2\\x+y=0,35\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,15\end{matrix}\right.\)
b) m=m(muối khan)= mMgCl2 + mFeCl2= 95.x+127y=95.0,2+127.0,15= 38,05(g)
a)
Gọi
\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 13,2(1)\)
\(Mg + 2HCl \to MgCl_2 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\)
Theo PTHH : \(n_{H_2} = a + b = 0,35(mol)\)(2)
Từ (1)(2) suy ra a = 0,15 ;b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,15.56}{13,2}.100\% = 63,64\%\\ \Rightarrow m_{Mg} = 100\% - 63,64\% = 36,36\%\)
b)
Ta có :\(n_{HCl} = 2n_{H_2} = 0,7(mol)\)
Bảo toàn khối lượng :
\(m_{muối} = m_{kim\ loại} + m_{HCl} - m_{H_2} = 13,2 + 0,7.36,5 - 0,35.2=38,05(gam)\)

Sửa đề: đktc → đkc
a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: 24nMg + 56nFe = 13,2 (1)
\(n_{H_2}=\dfrac{8,6765}{24,79}=0,35\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}+n_{Fe}=0,35\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,2\left(mol\right)\\n_{Fe}=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,2.24}{13,2}.100\%\approx36,36\%\\\%m_{Fe}\approx63,64\%\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\\n_{FeCl_2}=n_{Fe}=0,15\left(mol\right)\end{matrix}\right.\)
⇒ m muối khan = 0,2.95 + 0,15.127 = 38,05 (g)

Câu 1 : Mk nghĩ đề thiếu rồi
Câu 2:
nFe2O3=0,3\(\rightarrow\)nFe=0,6
Sau toàn bộ quá trình thu được Fe2(SO4)3
nFe2(SO4)3=0,3
\(\rightarrow\)mFe2(SO4)3=120

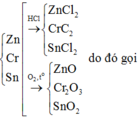
\(19,1gam\) \(:\left\{{}\begin{matrix}Al\\Mg\\Zn\end{matrix}\right.\)\(\underrightarrow{+O_2}\)\(Y:25,5gam\)\(\underrightarrow{+HCl}\left\{{}\begin{matrix}AgCl_3\\MgCl_2\\ZnCl_2\end{matrix}\right.\) + H2 : 0,3 mol
H2O
Áp dụng định luật bảo toàn khối lượng:
\(mO_2=25,5-19,1=6,4gam\) \(\Rightarrow nO_2=0,2\left(mol\right)\)
BTNT O : nH2O = 0,4mol
\(\rightarrow nHCl^-\left(tdOxi\right)=0,8\left(mol\right)\)
\(nH_2=0,3\left(mol\right)\rightarrow nCl^-\left(tdKl\right)=0,6\left(mol\right)\)
\(m_{muối}=19,1+\left(0,8+0,6\right).35,5=68,8\left(g\right)\)

10,8 g chất rắn đó là Ag không tan trong dd HCl
=> mMg + mAl = 23,7 - 10,8 = 12,9 (g)
nH2 = 14,56/22,4 = 0,65 (mol)
PTHH:
Mg + 2HCl -> MgCl2 + H2
2Al + 6HCl -> 2AlCl3 + 3H2
Theo 2 PTHH trên: nHCl = 2nH2 = 2 . 0,65 = 1,3 (mol)
Áp dụng ĐLBTKL, ta có:
mAl + mMg + mHCl = m(muối) + mH2
=> m(muối) = 12,9 + 36,5 . 1,3 - 0,65 . 2 = 59,05 (g)

\(n_{Zn}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(n_{H_2}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+H_2\)
\(n_{H_2}=a+1.5b=0.4\left(mol\right)\left(1\right)\)
\(m_{Muối}=m_{ZnCl_2}+m_{AlCl_3}=136a+133.5b=40.3\left(g\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.2\)
\(m_{hh}=0.1\cdot65+0.2\cdot27=11.9\left(g\right)\)
\(\%Zn=\dfrac{0.1\cdot65}{11.9}\cdot100\%=54.62\%\)
\(\%Al=100-54.62=45.38\%\)

Đáp án B
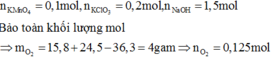
Khi cho hỗn hợp Y phản ứng với HCl đặc sẽ xảy ra phản ứng oxi hóa – khử tạo ra Cl2
![]()