Cho 100g dung dịch BaCl2 20,8% vào 100g dung dịch Na2CO3 , lọc bỏ kết tủa thu được dung dịch X . Tiếp tục cho 100g dung dịch H2SO4 9,8% vào dung dịch X thấy thoát ra 0,896 lít khí (đktc) . Biết phản ứng xảy ra hoàn toàn.Tính nồng đô % của dung dịch na2 , co3 và khối lượng dd thu được sau cùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Cho hỗn hợp tác dụng với dung dịch \(BaCl_2\)đủ cho đến khi kết tủa đạt tối đa, lọc kết tủa:
\(Na_2SO_4+BaCl_2\rightarrow BaSO_4+2NaCl\)
Hỗn hợp dung dịch khi này sau lọc kết tủa gồm \(NaCl,MgCl_2\)
Tiếp tục cho tác dụng với dung dịch \(NaOH\) đủ đến khi kết tủa tối đa, lọc kết tủa ta thu được muối ăn tinh khiết:
\(MgCl_2+2NaOH\rightarrow2NaCl+Mg\left(OH\right)_2\)
Để thu được muối ăn tinh khiết ta làm như sau:
-
Phơi nước biển và cô đặc: Phơi nước biển trên các ruộng muối để ánh nắng chiếu trực tiếp. Nước dễ dàng bay hơi nên ta có thể lấy được muối ăn.
-
Cô đặc dung dịch chứa NaCl: Sử dụng phương pháp cô đặc nồi hở.Cô đặc dung dịch chứa muối ăn để tạo ra muối tinh khiết.

Thuốc thử: \(Ba\left(HCO_3\right)_2,HCl\)
Lần lượt lấy mỗi dung dịch hỗn hợp ở các lọ làm mẫu thử thực hiện thí nghiệm sau:
- Cho từng mẫu thử tác dụng với dung dịch \(Ba\left(HCO_3\right)_2\) dư:
+ Mẫu thử có hiện tượng kết tủa trắng là mẫu: \(KHCO_3\) và \(K_2CO_3\), \(NaCl\) và \(Na_2SO_4\) (I)
\(K_2CO_3+Ba\left(HCO_3\right)_2\rightarrow BaCO_3\downarrow+2KHCO_3\)
\(Na_2SO_4+Ba\left(HCO_3\right)_2\rightarrow BaSO_4+2NaHCO_3\)
+ Mẫu thử có hiện tượng kết tủa trắng và có sủi bọt khí là mẫu: \(HCl\) và \(H_2SO_4\)
- Thu kết tủa của 2 mẫu ở (I) cho tác dụng với dung dịch HCl dư:
+ Kết tủa tan => kết tủa \(BaCO_3\) => Đó là mẫu chứa \(KHCO_3\) và \(K_2CO_3\)
\(BaCO_3+2HCl\rightarrow BaCl_2+H_2O+CO_2\)
+ Kết tủa không tan => kết tủa \(BaSO_4\) => Đó là mẫu chứa \(NaCl\) và \(Na_2SO_4\)

- Trích mẫu thử.
- Hòa tan từng mẫu thử vào nước.
+ Tan: Na2O
PT: \(Na_2O+H_2O\rightarrow2NaOH\)
+ Không tan: CuO, Al2O3, MgO. (1)
- Cho mẫu thử nhóm (1) pư với HCl rồi nhỏ NaOH thu được ở thí nghiệm trên vào.
+ Có tủa xanh: CuO
PT: \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(CuCl_2+2NaOH\rightarrow2NaCl+Cu\left(OH\right)_{2\downarrow}\)
+ Có tủa keo trắng rồi tan trong NaOH dư: Al2O3
PT: \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(2AlCl_3+6NaOH\rightarrow2Al\left(OH\right)_{3\downarrow}+6NaCl\)
\(Al\left(OH\right)_3+NaOH\rightarrow NaAlO_2+2H_2O\)
+ Có tủa trắng: MgO
PT: \(MgO+2HCl\rightarrow MgCl_2+H_2O\)
\(MgCl_2+2NaOH\rightarrow NaCl+Mg\left(OH\right)_{2\downarrow}\)
- Dán nhãn.

\(n_{Al_2O_3}=\dfrac{10,2}{27.2+16.3}=0,1\left(mol\right)\)
⇒ Số phân tử Al2O3 = 6,022.1023.0,1 = 6,022.1022 (phân tử)

1. Chứng minh hợp kim tan hết:
- Xét phản ứng của Fe với H2SO4:
- Fe + H2SO4 → FeSO4 + H2
- n(Fe) = m(Fe) / M(Fe)
- n(H2SO4) = C(H2SO4) * V(H2SO4) = 0,2 mol
- Từ phương trình phản ứng, ta thấy n(Fe) = n(H2SO4) = 0,2 mol
- m(Fe) = n(Fe) * M(Fe) = 11,2 gam
- Xét phản ứng của Ni với H2SO4:
- Ni + H2SO4 → NiSO4 + H2
- n(Ni) = m(Ni) / M(Ni) = (36,2 - 11,2) / 58,7 = 0,42 mol
- n(H2SO4) = 0,2 mol
- Từ phương trình phản ứng, ta thấy n(Ni) > n(H2SO4)
- Kết luận:
- Hợp kim tan hết vì lượng H2SO4 đủ để phản ứng với cả Fe và Ni.
2. Hợp kim gấp đôi có tan hết hay không?
- Lượng Fe và Ni gấp đôi:
- m(Fe) = 2 * 11,2 = 22,4 gam
- m(Ni) = 2 * (36,2 - 11,2) = 50 gam
- Lượng H2SO4 không đổi:
- n(H2SO4) = 0,2 mol
- Xét phản ứng:
- n(Fe) = m(Fe) / M(Fe) = 0,4 mol
- n(Ni) = m(Ni) / M(Ni) = 0,86 mol
- Từ phương trình phản ứng, ta thấy n(Fe) + n(Ni) > n(H2SO4)
- Kết luận:
- Hợp kim gấp đôi sẽ không tan hết vì lượng H2SO4 không đủ để phản ứng với cả Fe và Ni.
3. Tính khối lượng kim loại trong hợp kim:
- Tính lượng H2 sinh ra:
- n(H2) = m(CuO) / M(CuO) = 48 / 80 = 0,6 mol
- Tính lượng Fe và Ni:
- n(Fe) = n(H2) = 0,6 mol
- n(Ni) = n(H2) - n(Fe) = 0,6 - 0,6 = 0 mol
- Tính khối lượng Fe và Ni:
- m(Fe) = n(Fe) * M(Fe) = 0,6 * 56 = 33,6 gam
- m(Ni) = n(Ni) * M(Ni) = 0 * 58,7 = 0 gam
- Kết luận:
- Khối lượng Fe trong hợp kim là 33,6 gam.
- Khối lượng Ni trong hợp kim là 0 gam.
Lưu ý:
- Trong bài toán này, ta giả định rằng phản ứng xảy ra hoàn toàn.
- Nồng độ của dung dịch H2SO4 là 0,2M, không phải 0,耀M như trong đề bài.
Hy vọng bài giải này giúp bạn hiểu rõ hơn về bài toán.

Có vẻ hơi trễ:")
a)
\(n=3\Rightarrow\) có 3 lóp electron.
\(l=2\Rightarrow\) e cuối vào phân lớp 3d
\(m=1,m_s=-\dfrac{1}{2}\Rightarrow\) mũi tên hướng xuống dừng ở ô thứ 4.
=> e cuối của nguyên tố điền vào phân lớp \(3d^9\)
Cấu hình e bền vững sau bão hòa: \(1s^22s^22p^63s^23p^63d^{10}4s^1\left(Cu\right)\)
\(\Rightarrow\left\{{}\begin{matrix}STT:29\\CK:4\\nhóm:IB\end{matrix}\right.\)
b)
Tương tự câu a, e cuối của nguyên tố điền vào phân lóp \(4p^2\)
Cấu hình e: \(1s^22s^22p^63s^23p^63d^{10}4s^24p^2\left(Ge\right)\left\{{}\begin{matrix}STT:32\\CK:4\\nhóm:IVA\end{matrix}\right.\)

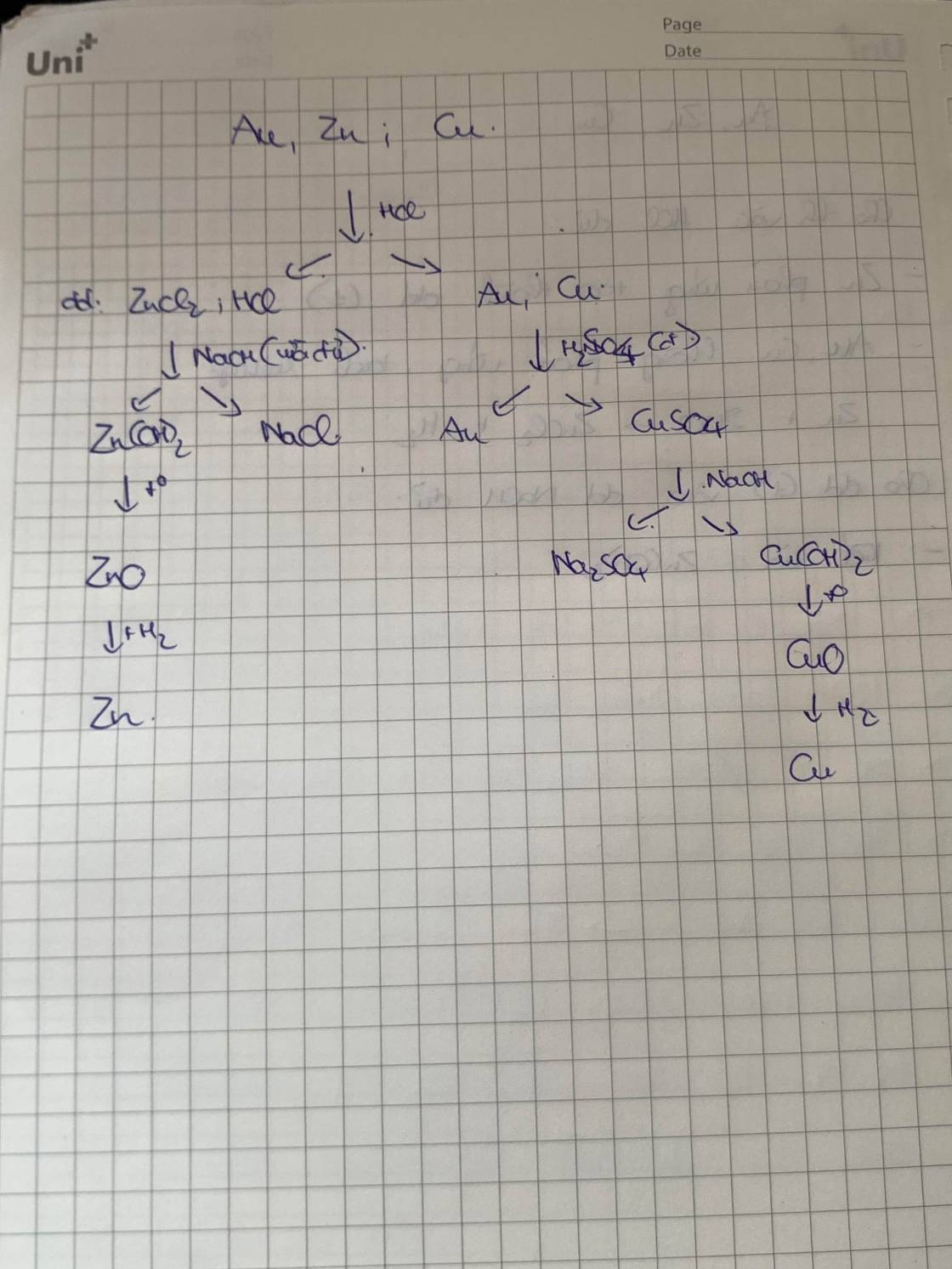
Bước 1: Nung chảy hỗn hợp của cả 3 kim loại.
Bước 2: Khi hỗn hợp đã nóng chảy, sẽ thấy các lớp kim loại tách ra dựa trên mật độ của chúng. Vàng, có mật độ cao hơn, sẽ nằm ở đáy. Đồng sẽ nằm ở giữa và kẽm sẽ ở trên cùng.
Bước 3: Dùng một cái muôi hoặc ống hút, là đã có thể lấy từng lớp kim loại ra khỏi hỗn hợp.
Tick cho e với

\(CaCO_3+2HCl\underrightarrow{ }CaCl_2+CO_2+H_2O\)
\(nCaCO_3=\dfrac{15}{100}=0,15\left(mol\right)\)
\(nHCl=\dfrac{20.36,5}{100.36,5}=0,2\left(mol\right)\)
Vậy \(CaCO_3\) dư
a. Rắn B là: CaCO3 dư
\(nCaCO_3\) phản ứng là: 0,2:2 = 0,1 (mol)
\(nCaCO_3\) dư : 0,05 (mol)
Khối lượng rắn CaCO3 là : 0,05.100 = 5 (g)
b. Theo PTHH em dễ dàng tính được nồng độ dd B (CaCl2):
Khối lượng CaCl2: 0,1.111 = 11,1(g)
Khối lượng khí CO2: 0,1.44 = 4,4 (g)
Khối lượng dd sau phản ứng:
15+20 - 5 - 4,4 = 25,6 (g)
Nồng độ % dung dịch CaCl2: \(\dfrac{11,1}{25,6}.100\%=43,36\%\)
c. Thể tích CO2 ở đtc:
0,1.24,79 = 2,479 (l)
\(n_{CaCO_3}=\dfrac{15}{100}=0,15mol\\ n_{HCl}=\dfrac{20.36,5}{100.36,5}=0,2mol\\ CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\\ \rightarrow\dfrac{0,15}{1}>\dfrac{0,2}{2}=>CaCO_3.dư\\ n_{CaCO_3pư}=n_{CaCl_2}=n_{CO_2}=\dfrac{0,2}{2}=0,1mol\\ a.m_B=m_{CaCO_3.dư}=\left(0,15-0.1\right).100=5g\\ b.m_{dd}=0,1.100+20-0,1.44=25,6g\\ C_{\%CaCl_2}=\dfrac{0,1.111}{25,6}\cdot100=43.36\%\\ c.ddC?\)
\(n_{co_2}=\dfrac{0,896}{22,4}=0,02\left(mol\right)\)
\(n_{BaCl_2}=\dfrac{100.20,8\%}{208}=0,1\left(mol\right)\)
PTHH :
\(BaCl_2+Na_2CO_3\rightarrow BaCO_3+2NaCl\) (1)
Như vậy : dung dịch X gồm \(BaCO_3;NaCl;\) có thể có \(BaCl_2\) dư hoặc \(Na_2CO_3\) dư
PTHH :
\(BaCO_3+H_2SO_4\rightarrow BaSO_4+CO_2+H_2O\) (2)
ctc : \(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+CO_2+H_2O\) (3)
+) TH1 : Nếu \(BaCl_2\) dư ( không có phản ứng (3) )
Theo phương trình (2) \(\Rightarrow n_{BaCO_3}=n_{CO_2}=0,04\left(mol\right)\)
Theo phương trình (1) \(\Rightarrow n_{Na_2CO_3}=n_{BaCO_3}=0,04\left(mol\right)\)
\(\Rightarrow m_{Na_2CO_3}=0,04.106=4,24\left(g\right)\)
\(\Rightarrow C_{\%ddNa_2CO_3}=\dfrac{4,24.100\%}{100}=4,24\%\)
BTKL \(\Rightarrow m_{ddBaCl_2}+m_{ddNa_2CO_3}+m_{ddH_2SO_4}=m_{ddspứ}+m_{CO_2}\)
\(\Rightarrow m_{ddBaCl_2}+m_{ddNa_2CO_3}+m_{ddH_2SO_4}-m_{CO_2}=m_{ddspứ}\)
\(\Rightarrow m_{ddspứ}=100+100+100-0,04.44=298,14\left(g\right)\)
+) TH2 : Nếu \(Na_2CO_3\) dư ( xảy ra phản ứng (3) )
Theo phương trình (1) \(\Rightarrow n_{BaCO_3}=n_{BaCl_2}=0,1\left(mol\right)\)
Theo phương trình (2) \(\Rightarrow n_{CO_2\left(2\right)}=n_{BaCO_3\left(1\right)}=0,1\left(mol\right)>0,04\left(mol\right)\) ( vô lí )
\(\Rightarrow\) TH2 loại