Vẽ sơ đồ khái quát trình tự lập luận trong các văn bản nghị luận trung đại đã học:Nước Đại Việt ta , Bàn luận về phép học , Hịch tướng sĩ , Chiếu dời đô
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, (4 - x )5 +(x - 2)5 =32
(=) 1024 - x5 + x5 - 32 = 32
(=) -x5 + x5 = 32 + 32 - 1024
(=) 0x = -960
=) phương trình vô nghiệm

Em tham khảo nhé.
Đây là chương trình tìm tổng A:
```
var n, A: real;
write('Nhap vao so n: ');
readln(n);
A := 0;
for var i := 1 to Round(n) do
begin
A := A + 1/i;
end;
writeln('Tong A la: ', A:0:2);
```
Giải thích chương trình:
1. Sử dụng lệnh `readln` để nhập giá trị `n` từ bàn phím.
2. Khởi tạo biến `A` là 0.
3. Sử dụng vòng lặp `for` để tính tổng từ 1 đến `n`.
4. Cộng giá trị của 1/i vào biến `A`.
5. In ra giá trị của `A` với độ chính xác 2 chữ số thập phân bằng lệnh `writeln`.

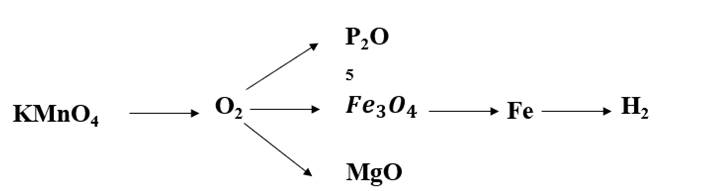
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(2Mg+O_2\underrightarrow{t^o}2MgO\)
\(Fe_3O_4+4H_2\underrightarrow{^o}3Fe+4H_2O\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)

a, \(CaCO_3\underrightarrow{t^o}CaO+CO_2\)
b, Theo ĐLBT KL, có: mCaCO3 = mCaO + mCO2 = 1,12 + 0,88 = 2 (tấn)
⇒ m đá vôi = mCaCO3 : 89% = 200/89 (tấn)

- Dẫn từng khí qua CuO nung nóng.
+ Chất rắn chuyển từ đen sang đỏ: H2.
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
+ Không hiện tượng: Không khí, O2, N2. (1)
- Cho tàn đóm đỏ vào khí nhóm (1)
+ Que đóm bùng cháy: O2.
+ Que đóm cháy 1 lúc rồi tắt: không khí.
+ Không hiện tượng: N2

a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Ta có: \(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}=0,3\left(mol\right)\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b, \(n_{Fe_2O_3}=\dfrac{48}{160}=0,3\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,3}{3}\), ta được Fe2O3 dư.
Theo PT: \(n_{Fe_2O_3\left(pư\right)}=\dfrac{1}{3}n_{H_2}=0,1\left(mol\right)\Rightarrow n_{Fe_2O_3\left(dư\right)}=0,3-0,1=0,2\left(mol\right)\)
\(\Rightarrow m_{Fe_2O_3}=0,2.160=32\left(g\right)\)

Ta có: \(n_{KClO_3}=\dfrac{49}{122,5}=0,4\left(mol\right)\)
PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
______0,4______0,4_____0,6 (mol)
\(\Rightarrow m_{KCl}=0,4.74,5=29,8\left(g\right)\)
\(V_{O_2}=0,6.22,4=13,44\left(l\right)\)