Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Cân bằng trong dung dịch nước SVIP
1. SỰ ĐIỆN LI, CHẤT ĐIỆN LI, CHẤT KHÔNG ĐIỆN LI
➤ Hiện tượng điện li
Sự điện li là hiện tượng các chất tan trong nước phân li thành ion.
Chất điện li là chất có khả năng tan trong nước tạo ra ion.
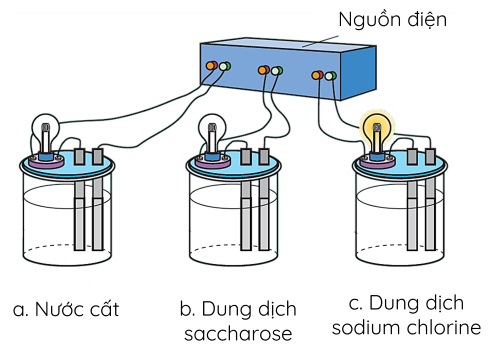
Ví dụ: Thử tính dẫn điện của nước, dung dịch muối ăn và dung dịch đường:
Câu hỏi:
@205887185566@
Nước là phân tử phân cực. Khi hòa tan NaCl vào nước, các phân tử nước tương tác với ion Na+ và Cl-, làm chúng tách khỏi mạng tinh thể và tan vào nước tạo thành dung dịch dẫn điện.
\(NaCl\rarr Na^{+}+Cl^{-}\)
➤ Phân loại các chất điện li
- Chất điện li mạnh là chất khi tan trong nước phân li hoàn toàn thành ion (biểu diễn: →).
- Chất điện li yếu là chất khi tan trong nước chỉ phân li một phần thành ion, phần còn lại tồn tại dưới dạng phân tử (biểu diễn: ⇌).
- Chất không điện li là chất khi tan trong nước không phân li ra ion.
Thí nghiệm mô phỏng tính dẫn điện của một số dung dịch:

- Chất điện li mạnh thường là các acid mạnh, base mạnh và muối tan.
Ví dụ: HCl, HNO3, Ba(OH)2, Na2SO4, BaCl2,...
Phương trình phân li:
\(Na_2SO_4\rarr2Na^{+}+SO_4^{2-}\)
- Chất điện li yếu thường là các acid yếu, base yếu.
Ví dụ: CH3COOH, H2CO3, H2S, NH3,...
Phương trình phân li:
\(CH_3COOH\rightleftharpoons CH_3COO^{-}+H^{+}\)
Câu hỏi:
@201172858802@
2. THUYẾT BRØNSTED - LOWRY VỀ ACID - BASE
Theo thuyết Brønsted - Lowry:
- Acid là chất cho proton (H+).
- Base là chất nhận proton (H+).
Ví dụ: HCl cho H+ nên đóng vai trò là acid, H2O nhận H+ nên đóng vai trò là base.

Ví dụ: Đối với phản ứng thuận, NH3 nhận H+ nên đóng vai trò là base, H2O cho H+ nên đóng vai trò là acid. Đối với phản ứng nghịch, ion NH4+ là acid còn OH- là base.

Ví dụ: Ion HCO3- vừa có thể cho H+, vừa có thể nhận H+ nên ion này có tính chất lưỡng tính.


Câu hỏi:
@205848405635@
3. KHÁI NIỆM pH, CHẤT CHỈ THỊ ACID - BASE
➤ Khái niệm pH
- pH là đại lượng dùng để đánh giá độ acid hoặc base của dung dịch.
- Công thức tính pH:
pH = -lg[H+] hay [H+]=10-pH
Phương trình điện li của nước:
\(H_2O\rightleftharpoons H^{+}+OH^{-}\) \(K_{W}=\left\lbrack H^{+}\right\rbrack.\left\lbrack OH^{-}\right\rbrack=10^{-14}\)
KW (tích số ion của nước) là một hằng số. Trong nước ở 25 oC, nồng độ ion H+ và OH- rất nhỏ: [H+] = [OH-] = 10-7 M.
- Môi trường acid: [H+] > [OH-], khi đó pH < 7.
- Môi trường base: [H+] < [OH-], khi đó pH > 7.
- Môi trường trung tính: [H+] = [OH-] = 10-7 M, khi đó pH = 7.
- Thang pH có giá trị từ 1 đến 14:

Câu hỏi:
@205848439726@
➤ Ý nghĩa của pH trong thực tiễn
Chỉ số pH có vai trò quan trọng trong tự nhiên, y học và đời sống hằng ngày.
- Máu, dịch vị dạ dày, dịch mật,... trong cơ thể có giá trị pH ổn định trong một khoảng nhất định. Sự thay đổi pH bất thường có thể ảnh hưởng đến sức khỏe. Vì thế, việc duy trì chế độ ăn uống phù hợp sẽ giúp cân bằng pH trong cơ thể.

- Độ pH của đất là căn cứ để lựa chọn cách cải tạo đất và bón phân hợp lí, góp phần giữ gìn chất lượng đất và hạn chế ô nhiễm nguồn nước.
- Theo quy định, nước chỉ đạt tiêu chuẩn khi độ pH nằm trong khoảng từ 6 đến 8,5.
Câu hỏi:
@205887206954@
➤ Chất chỉ thị acid - base
Chất chỉ thị acid - base là chất đổi màu theo pH của dung dịch.
Giá trị pH có thể xác định gần đúng bằng chất chỉ thị acid - base hoặc chính xác bằng máy đo pH.
Ví dụ: Giấy quỳ (1), phenolphthalein (2), giấy pH (3).

Câu hỏi:
@202974032653@
4. CHUẨN ĐỘ ACID - BASE
Chuẩn độ là phương pháp xác định nồng độ của một chất dựa trên phản ứng với một dung dịch chuẩn đã biết nồng độ và đo thể tích phản ứng vừa đủ.
Thao tác chuẩn độ:
- Trong chuẩn độ, dung dịch từ burette được nhỏ từ từ vào dung dịch trong bình tam giác.
- Tay thuận giữ bình tam giác và lắc nhẹ để trộn đều, tay còn lại điều chỉnh khóa burette để nhỏ từng giọt.
- Điểm tương đương là khi hai chất phản ứng vừa đủ, được nhận biết qua sự đổi màu của chất chỉ thị.
⚡THÍ NGHIỆM
- Rót dung dịch NaOH vào burette và chỉnh mức về vạch số 0.

- Dùng pipette lấy 10 mL dung dịch HCl 0,1 M cho vào bình tam giác, thêm 1 - 2 giọt phenolphthalein làm chất chỉ thị.

- Nhỏ từ từ NaOH vào bình tam giác, vừa nhỏ vừa lắc đều cho đến khi dung dịch chuyển sang màu hồng nhạt bền (khoảng 30 giây).

- Ghi lại thể tích NaOH đã sử dụng để tính toán.
- Chuẩn độ ít nhất 3 lần và lấy giá trị trung bình.
Nồng độ mol của dung dịch NaOH được tính theo công thức:
\(C_{NaOH}=\dfrac{V_{HCl}.C_{HCl}}{V_{NaOH}}\)
Câu hỏi:
@205848462344@
5. Ý NGHĨA THỰC TIỄN CÂN BẰNG TRONG DUNG DỊCH NƯỚC CỦA ION Al3+, Fe3+ VÀ CO32-
Các ion sinh ra từ muối hòa tan có khả năng tương tác với nước, dẫn đến sự thay đổi môi trường của dung dịch. Quá trình này được gọi là phản ứng thủy phân.
➤ Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+
Phèn nhôm - kali (K2SO4.Al2(SO4)3.24H2O), phèn sắt ((NH4)2SO4.Fe2(SO4)3.24H2O) được dùng làm chất keo tụ trong xử lí nước do tạo ra Al(OH)3 và Fe(OH)3 ở dạng keo. Các hợp chất này có khả năng cuốn theo chất bẩn lơ lửng và kéo chúng lắng xuống đáy.

Phương trình thủy phân đơn giản:
\(M^{3+}+3H_2O⇌M\left(OH\right)_3\downarrow+3H^+\)
Câu hỏi:
@205848459143@
➤ Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion CO32-
Hồ bơi tiêu chuẩn có độ pH dao động từ 7,2 đến 7,8. Khi pH bị giảm, có thể điều chỉnh bằng cách bổ sung soda (Na2CO3). Trong dung dịch, ion CO32- thủy phân theo phương trình:
\(CO_3^{2-}+H_2O\rightleftharpoons HCO_3^{-}+OH^{-}\)
Bạn có thể đăng câu hỏi về bài học này ở đây
