Nung nóng 25,4 gam h² Cu(Oh)2 Al(OH)3 đếm khối lượng ko đổi thu 18,2 gam Tìm khối lượng muối oxit o h² ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Trích mẫu thử :
Cho quỳ tím vào từng mẫu thử :
+ Hóa đỏ : H2SO4
+ Hóa xanh : KOH
+ Không đổi màu : K2SO4 , KCl
Cho dung dịch BaCl2 vào 2 mẫu thử không làm quỳ tím đổi màu
+ Chất nào xuất hiện kết tủa trắng : K2SO4
Pt : BaCl2 + K2SO4 → BaSO4 + KCl
Không hiện tượng : KCl
Chúc bạn học tốt

1.
Trích các mẫu thử rồi đánh dấu.
- Cho quỳ tím vào các mẫu thử:
Mẫu thử làm quỳ tím hóa xanh là: \(NaOH\).
Mẫu thử làm quỳ tím không đổi màu là: \(K_2SO_4\).
Còn lại 2 mẫu thử làm quỳ tím hóa đỏ là: \(HCl;H_2SO_4\).
- Cho dung dịch \(BaCl_2\) vào hai mẫu thử \(HCl;H_2SO_4\):
Mẫu thử xuất hiện kết tủa trắng là: \(H_2SO_4\).
Còn lại \(HCl\) không xảy ra hiện tượng.
PTHH: \(BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)

BT1
PTHH
CuO + H2SO4 ------> CuSO4 + H2O
Fe2O3 + 3H2SO4 ------> Fe2(SO4)3 + 3H2O
Ta có :
n H2SO4 = 0,4 ( mol )
Gọi n CuO = a, n Fe2O3 = b
Ta có HPT
a + 3b = 0,4
80a + 160b = 24
Nên a = b = 0,1 ( mol )
=> m CuO = 8 ( g ) ; n Fe2O3 = 16 ( g )
=> %m CuO = 33,33 %
%m Fe2O3 = 66,67 %
BT2
- Khử hỗn hợp ban đầu bằng khí CO dư thu đc hh A
CuO + CO ----> Cu + CO2
FeO + CO -----> Fe + CO2
- Hòa tan hh A bằng dd HCl dư, lọc chất rắn ko tan thu đc Cu
Fe + 2HCl ---> FeCL2 + H2
- Nung nóng Cu ngoài không khí thu đc CuO
Cu + 1/2 O2 ---> CuO

Bài 2;
- Sục khí CO dư rồi nung nóng hỗn hợp thu đươc hỗn hợp kim loại Fe và Cu
PTHH: \(CuO+CO\xrightarrow[]{t^o}Cu+CO_2\)
\(FeO+CO\xrightarrow[]{t^o}Fe+CO_2\)
- Lấy nam châm hút sắt ra, ta thu được Cu
- Đốt Cu trong không khí, ta thu được CuO
PTHH: \(Cu+\dfrac{1}{2}O_2\xrightarrow[]{t^o}CuO\)

a)
(1) \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
(2) \(Fe+\dfrac{3}{2}Cl_2\xrightarrow[]{t^o}FeCl_3\)
(3) \(FeCl_2+\dfrac{1}{2}Cl_2\rightarrow FeCl_3\)
(4) \(2FeCl_3+Fe\rightarrow3FeCl_2\)
(5) \(FeCl_2+2KOH\rightarrow Fe\left(OH\right)_2+2KCl\)
(6) \(FeCl_3+3KOH\rightarrow Fe\left(OH\right)_3+3KCl\)
(7) \(Fe\left(OH\right)_2\xrightarrow[không.có.Oxi]{t^o}FeO+H_2O\)
(8) \(2Fe\left(OH\right)_3\xrightarrow[]{t^o}Fe_2O_3+3H_2O\)
(9) \(4Fe\left(OH\right)_2+O_2+2H_2O\rightarrow4Fe\left(OH\right)_3\)
(10) \(2FeO+\dfrac{1}{2}O_2\xrightarrow[]{t^o}Fe_2O_3\)
(11) \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
(12) \(Fe_2O_3+3CO\xrightarrow[]{t^o}2Fe+3CO_2\)
(13) \(2FeO+4H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}Fe_2\left(SO_4\right)_3+SO_2+4H_2O\)
(14) \(FeO+CO\xrightarrow[]{t^o}Fe+CO_2\)
c)
\(Ca+2H_2O\rightarrow Ca\left(OH\right)_2+H_2\uparrow\)
\(Ca\left(OH\right)_2+2HCl\rightarrow CaCl_2+2H_2O\)
\(CaCl_2+K_2CO_3\rightarrow2KCl+CaCO_3\)
\(CaCO_3+CO_2+H_2O\rightarrow Ca\left(HCO_3\right)_2\)
\(Ca\left(HCO_3\right)_2+2KOH\rightarrow CaCO_3+K_2CO_3+2H_2O\)
\(CaCO_3\xrightarrow[]{t^o}CaO+CO_2\)

a) PTHH: SO2 + 2 NaOH -> Na2SO3 + H2O
b) Vì p.ứ chỉ tạo sp là muối Na2SO3 và H2O
=> nNaOH= 2.nSO2= 2. (3,36/22,4)= 0,3(mol)
=> mNaOH= 0,3.40=12(g)
=>C%ddNaOH= (12/300).100=4%
c) mddNa2SO3= mSO2 + mddNaOH= 0,15. 64+300= 309,6(g)
nNa2SO3=nSO2= 0,15(mol) => mNa2SO3= 0,15.126=18,9(g)
C%ddNa2SO3= (18,9/309,6).100=6,105%
Số mol của khí lưu huỳnh đioxit
nSO2 = \(\dfrac{V_{SO2}}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) Pt : SO2 + 2NaOH → Na2SO3 + H2O\(|\)
1 2 1 1
0,15 0,3 0,15
b) Số mol của natri hidroxit
nNaOH= \(\dfrac{0,15.2}{1}=0,3\left(mol\right)\)
Khối lượng của natri hidroxit
mNaOH = nNaOH . MNaOH
= 0,3 . 40
= 12 (g)
Nồng độ phần trăm của dung dịch natri hidroxit
C0/0NaOH = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{12.100}{300}=4\)0/0
c) Số mol của muối natri sunfit
nNa2SO3 = \(\dfrac{0,3.1}{2}=0,15\left(mol\right)\)
Khối lượng của muối natri sunfit
mNa2SO3 = nNa2SO3 . MNa2SO3
= 0,15 . 126
= 18,9 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mSO2 + mNaOH
= (0,15 . 64) + 300
= 309,6 (g)
Nồng độ phần trăm của muối natri sunfit
C0/0Na2SO3 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{18,9.100}{309,6}=6,1\)0/0
Chúc bạn học tốt

Bài 2:
Na2O + H2O -> 2 NaOH
2 NaOH + SO2 -> Na2SO3 + H2O
Na2SO3 + H2SO4 -> Na2SO4 + SO2 + H2O
SO2 + K2O -> K2SO3
Bài 4:
CaCO3 -to-> CaO + CO2
CO2 + H2O -> Ca(OH)2
Ca(OH)2 + CO2 -> CaCO3 + H2O
CaCO3 + 2 HNO3 -> Ca(NO3)2 + CO2 + H2O
Bài 3:
a) 2 KOH + SiO2 -> K2SiO3 + H2O
KOH + SiO2 -> KHSiO3
b) 2 KOH + SO3 -> K2SO4 + H2O
KOH + SO3 -> KHSO4
c) CO2 + 2 KOH -> K2CO3 + H2O
CO2 + KOH -> KHCO3
d) P2O5 + 6 KOH -> 2 K3PO4 + 3 H2O
P2O5 + 4 KOH -> 2 K2HPO4 + H2O
P2O5 + 2 KOH + H2O -> 2 KH2PO4


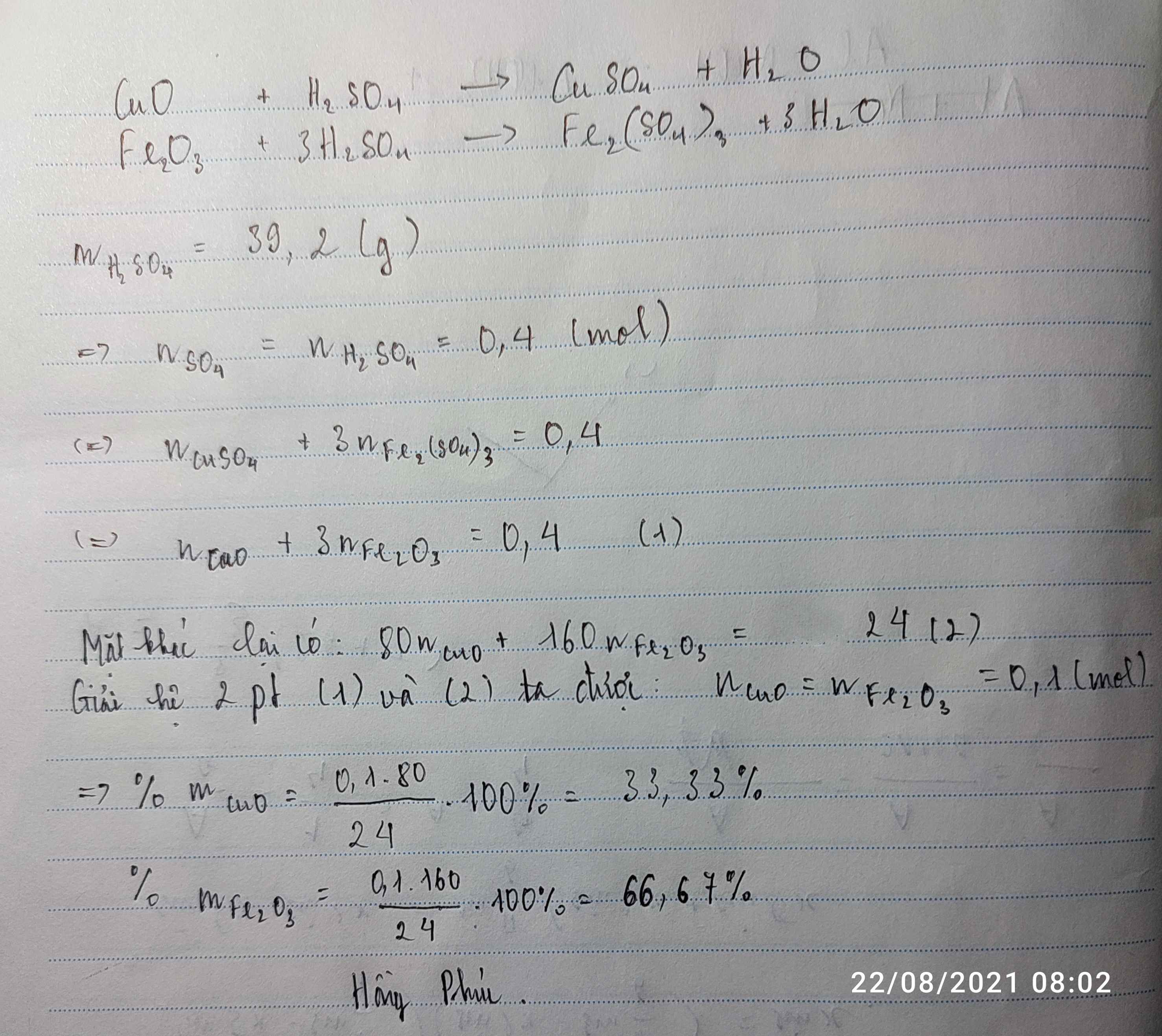



PTHH:
\(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
Theo giả thiết ta có:
\(98n_{Cu\left(OH\right)_2}+78n_{Al\left(OH\right)_3}=25,4\left(1\right)\)
Mặt khác: \(\left\{{}\begin{matrix}n_{Cu\left(OH\right)_2}=n_{CuO}\\n_{Al\left(OH\right)_3}=2n_{Al_2O_3}\end{matrix}\right.\)
Khi đó:
\(80n_{CuO}+102n_{Al_2O_3}=18,2\)
\(\Leftrightarrow80n_{Cu\left(OH\right)_2}+51n_{Al\left(OH\right)_3}=18,2\left(2\right)\)
Giải hệ hai phương trình (1) và (2) ta được:
\(\left\{{}\begin{matrix}n_{Cu\left(OH\right)_2}=0,1\left(mol\right)\\n_{Al\left(OH\right)_3}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Cu\left(OH\right)_2}=9,8\left(g\right)\\n_{Al\left(OH\right)_3}=15,6\left(g\right)\end{matrix}\right.\)
Đề phải là tìm khối lượng mỗi bazo trong hỗn hợp ban đầu hoặc oxit trong hỗ hợp sau nhiệt phân chứ.