
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


| Tên thường | |
| HCOO- | Gốc fomic |
| CH3COO- | Gốc axetic |
| C2H5COO- | Gốc propinic |
| CH3CH2CH2COO- | Gốc butiric |
| CH2=CH-COO- | Gốc acrylic |
| CH2=C(CH3)-COO- | Gốc metacrylic |
| C6H5-COO- | Gốc benzoic |
| (COO-)2 |

\(FeCl_3+3AgNO_3\rightarrow Fe\left(NO_3\right)_3+3AgCl\downarrow\)
\(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)

Thuốc thử: \(Ba\left(HCO_3\right)_2,HCl\)
Lần lượt lấy mỗi dung dịch hỗn hợp ở các lọ làm mẫu thử thực hiện thí nghiệm sau:
- Cho từng mẫu thử tác dụng với dung dịch \(Ba\left(HCO_3\right)_2\) dư:
+ Mẫu thử có hiện tượng kết tủa trắng là mẫu: \(KHCO_3\) và \(K_2CO_3\), \(NaCl\) và \(Na_2SO_4\) (I)
\(K_2CO_3+Ba\left(HCO_3\right)_2\rightarrow BaCO_3\downarrow+2KHCO_3\)
\(Na_2SO_4+Ba\left(HCO_3\right)_2\rightarrow BaSO_4+2NaHCO_3\)
+ Mẫu thử có hiện tượng kết tủa trắng và có sủi bọt khí là mẫu: \(HCl\) và \(H_2SO_4\)
- Thu kết tủa của 2 mẫu ở (I) cho tác dụng với dung dịch HCl dư:
+ Kết tủa tan => kết tủa \(BaCO_3\) => Đó là mẫu chứa \(KHCO_3\) và \(K_2CO_3\)
\(BaCO_3+2HCl\rightarrow BaCl_2+H_2O+CO_2\)
+ Kết tủa không tan => kết tủa \(BaSO_4\) => Đó là mẫu chứa \(NaCl\) và \(Na_2SO_4\)

\(_{20}Ca:\left[Ar\right]4s^2:I_2=11,87\\ _{21}Sc:\left[Ar\right]3d^14s^2:I_2=12,8\\ _{22}Ti:\left[Ar\right]3d^24s^2:I_2=13,58\\ _{23}V:\left[Ar\right]3d^34s^2:I_2=14,15\\ _{24}Cr:\left[Ar\right]3d^54s^1:I_2=16,5\\ _{25}Mn:\left[Ar\right]3d^54s^2:I_2=15,64\)
Giải thích: từ \(_{20}Ca\) đến \(_{23}V\) có sự tách electron từ `4s` thứ 2. Do có sự tăng điện tich hạt nhân nên lực hút giữa hạt nhân và các electron 4s tăng dần.
=> Năng lượng ion hóa \(I_2\) tăng dần.
Đối với \(_{24}Cr\) do có cấu hình electron đặc biệt, năng lượng ion hóa \(I_2\) là năng lượng cần thiết để tách electron ths 2 ra khỏi cấu hình \(3d^5\) bền vững nên năng lượng ion hóa \(I_2\) của `Cr` cao hơn `I_2` của V và `Mn`

\(Ne:..2s^22p^6\) cấu hình bền vững
\(Na:..2s^22p^63s^1\) có electron 3s dễ tách ra khỏi nguyên tử để có cấu hình bền vững của khí hiếm `Ne`
=> \(I_1\left(Na\right)< I_1\left(Ne\right)\)
\(Mg:..2s^22p^63s^2\) có điện tích hạt nhân lớn hơn so với `Na` nên \(I_1\left(Mg\right)>I_1\left(Na\right)\)
Vậy: \(I_1\left(Na\right)=5,14;I_1\left(Mg\right)=7,64\\ I_1\left(Ne\right)=21,58\)
\(Na^+\) có cấu hình có cấu hình bền vững của Ne, trong khi đó \(Ne^+\) có cấu hình kém bền. Sự tách electron ra khỏi cấu hình bền vững của \(Na^+\) đòi hỏi lượng năng lượng I2 lớn hơn I2 của Ne.
\(Mg^+:\left[Ne\right]3s^1\) trong đó thấy electron ở 3s dễ tách ra khỏi nguyên tử để có cấu hình bền vững của Ne nên I2 của Mg nhỏ hơn I2 của Na.
=> \(I_2\left(Mg\right)< 42,79\)

Có:
\(Li\rightarrow Li^++1e\left(I_1=5,39eV\right)\)
\(Li\rightarrow Li^{2+}+2e\left(I_{12}=81,009eV\right)\)
=> \(Li^+\rightarrow Li^{2+}+1e\) \(I_2=I_{12}-I_1=75,619eV\)
\(Li^{2+}\rightarrow Li^{3+}+1e\left(I_3=-E_3\right)\)
\(Li^{2-}\) là hệ 1 electron 1 hạt nhân, nên năng lượng của electron được tính theo công thức:
\(E_3=-13,6.\dfrac{Z^2}{n^2}=-13,6.\dfrac{3^2}{1^2}=-122,4eV\Rightarrow I_3=122,4eV\)
\(Li\rightarrow Li^{3+}+3e\) \(I=I_1+I_2+I_3=203,409eV\)

Giả sử tác dụng của bức xạ chỉ tách electron từ phân tử nitrogen.
\(h\upsilon=\dfrac{1}{2}mv_i^2+I_i\Rightarrow I_i=h\upsilon-\dfrac{1}{2}mv_i^2\left(1\right)\)
\(h\upsilon=6,6261.10^{-23}.2,9979.10^8.\dfrac{1}{58,43.10^{-9}}.6,0221.10^{23}.10^{-3}=2050,485\left(kJ.mol^{-1}\right)\)
Thay vào (1) tính được: \(\left\{{}\begin{matrix}I_1=1507,335kJ.mol^{-1}\\I_2=1610,867kJ.mol^{-1}\end{matrix}\right.\)

a)
Thứ tự giảm \(I_1\) là Li, Na, K
Căn cứ: Các nguyên tố đó đều thuộc nhóm IA, có 1 electron hóa trị từ trên xuống tuy điện tích hạt nhân tăng dần nhưng bán kính nguyên tử tăng nhanh do số lớp electron tăng nên lực hút giữa hạt nhân với electron hóa trị giảm từ trên xuống. Kết quả: `I_1` giảm từ trên xuống.
b) \(Mg\left(Z=12\right):1s^22s^22p^63s^2;Al\left(Z=13\right):1s^22s^22p^63s^23p^1\)
Khi tách 1 electron của Mg từ phân lớp bão hòa \(3s^1\) phải tốn nhiều năng lượng hơn khi tách 1 electron của Al từ phân lớp chưa bão hòa \(3p^1\). => \(I_1\left(Mg\right)>I_1\left(Al\right)\)

a)
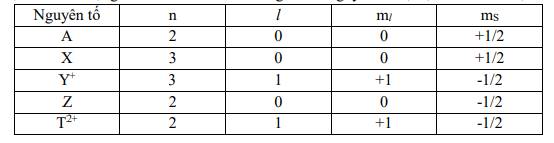
\(A:...2s^1\\ X:...3s^1\\ Y^+:...3p^6\Rightarrow Y:...4s^1\\ Z:...2s^2\\ T^{2+}:...2p^6\Rightarrow T:...3s^2\)
\(A\left(Z=3\right):1s^22s^1:Li\\ X\left(Z=11\right):1s^22s^22p^63s^1:Na\\ Y\left(Z=19\right):1s^22s^22p^63s^23p^64s^1:K\\ Z\left(Z=4\right):1s^22s^2:Be\\ T:\left(Z=12\right):1s^22s^22p^63s^2:Mg\)
\(Y^+:K^+\\ T^{2+}:Mg^{2+}\)
b)
Ion có bán kính lớn nhất là ion\(K^+\)
Giải thích: Vì xét theo bảng tuần hoàn hoá học, từ trên xuống bán kính nguyên tử tăng dần theo cùng nhóm, từ trái qua bán kính nguyên tử giảm dần theo cùng chu kì.
\(NaHCO_3\) được dùng để làm bột nở
NaHCO3