Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Tốc độ phản ứng và chất xúc tác SVIP
1. Tốc độ phản ứng hoá học
➤ Tìm hiểu khái niệm tốc độ phản ứng hóa học
Một số hiện tượng do các phản ứng hóa học xảy ra.

|

|
Tốc độ phản ứng là đại lượng chỉ mức độ nhanh hay chậm của một phản ứng hoá học.
2. Các yếu tố ảnh hưởng đến tốc độ phản ứng
➤ Thí nghiệm 1: Ảnh hưởng của nồng độ đến tốc độ phản ứng
Dụng cụ và hoá chất: 2 ống nghiệm, 2 ống hút nhỏ giọt, dung dịch sulfuric acid (H2SO4) 0,1 M và 2,0 M, 2 mảnh kim loại magnesium (Mg) tương tự nhau.
Cách tiến hành:
Bước 1: Cho mảnh magnesium vào từng ống nghiệm.
Bước 2: Lấy 5 mL dung dịch H2SO4 0,1 M cho vào ống nghiệm (1) và 5 mL dung dịch H2SO4 2,0 M cho vào ống nghiệm (2). Quan sát hiện tượng xảy ra trong 2 ống nghiệm.
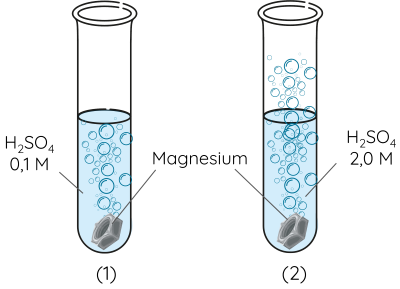
Nồng độ có ảnh hưởng đến tốc độ của phản ứng hoá học. Nồng độ các chất phản ứng càng cao, tốc độ phản ứng càng nhanh.
➤ Thí nghiệm 2: Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
Dụng cụ và hoá chất: 2 ống nghiệm, ống hút nhỏ giọt, đèn cồn, dung dịch sulfuric acid (H2SO4) 2,0 M, 6 hạt kẽm (Zn) tương tự nhau.
Cách tiến hành:
Bước 1: Cho 3 hạt kẽm vào từng ống nghiệm đã đánh số thứ tự (1) và (2).
Bước 2: Lấy 5 mL dung dịch H2SO4 2,0 M cho vào mỗi ống nghiệm.
Bước 3: Dùng đèn cồn đun nhẹ một lát rồi đun trực tiếp đáy ống nghiệm (1), ống nghiệm (2) không đun. Quan sát hiện tượng xảy ra trong 2 ống nghiệm.
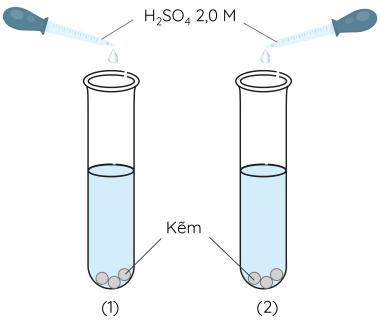
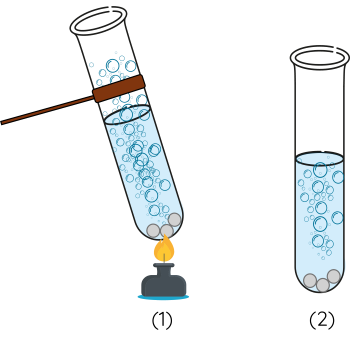
Nhiệt độ có ảnh hưởng đến tốc độ của phản ứng hoá học. Khi tăng nhiệt độ, phản ứng diễn ra với tốc độ nhanh hơn.
➤ Thí nghiệm 3: Ảnh hưởng của diện tích tiếp xúc đến tốc độ phản ứng
Dụng cụ và hoá chất: 2 ống nghiệm, kẹp sắt, dung dịch hydrochloric acid (HCl) và đá vôi (dạng bột và dạng viên) có cùng khối lượng.
Cách tiến hành:
Bước 1: Cho vào ống nghiệm (1) một mẫu đá vôi nhỏ, ống nghiệm (2) một ít bột đá vôi đã nghiền mịn.
Bước 2: Thêm 5 mL dung dịch HCl vào lần lượt từng ống nghiệm. Quan sát hiện tượng xảy ra trong 2 ống nghiệm.
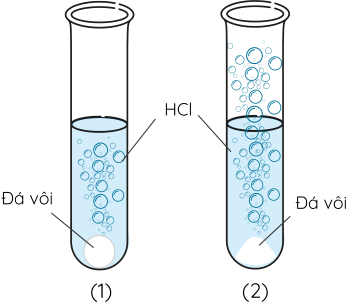
Nếu chia một vật thành nhiều phần nhỏ hơn thì tổng diện tích bề mặt sẽ tăng lên. Diện tích bề mặt tiếp xúc càng lớn, tốc độ phản ứng càng nhanh.
➤ Thí nghiệm 4: Ảnh hưởng của chất xúc tác tới tốc độ phản ứng
Dụng cụ và hoá chất: 2 ống nghiệm, đèn cồn, thìa xúc hoá chất, kẹp sắt, giá thí nghiệm, potassium chlorate (KClO3), manganese dioxide (MnO2).
Cách tiến hành:
Bước 1: Cho vào ống nghiệm (1) 5 gam KClO3 và ống nghiệm (2) hỗn hợp gồm 5 gam KClO3 và một ít MnO2 đã trộn đều.
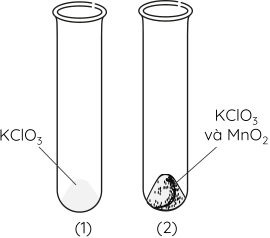
Bước 2: Lắp đặt 2 ống nghiệm trên giá sắt như hình dưới đây.
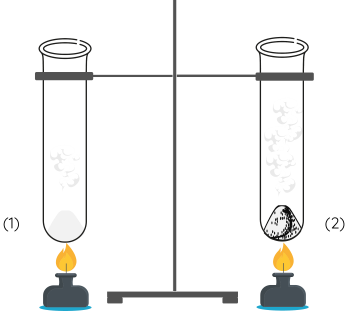
Bước 3: Đun nóng cùng lúc 2 ống nghiệm trên lửa đèn cồn.
Bước 4: Đưa lại gần miệng 2 ống nghiệm que đóm còn tàn đỏ. Quan sát hiện tượng xảy ra trong 2 ống nghiệm.
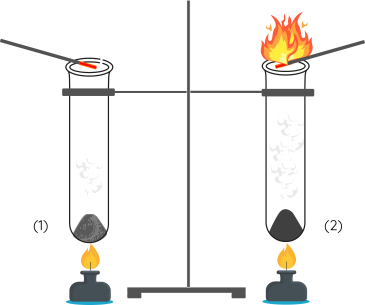
Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng không bị thay đổi cả về chất và lượng sau phản ứng.
3. Ứng dụng thực tiễn của tốc độ phản ứng
➤ Tìm hiểu một số ứng dụng thực tiễn của tốc độ phản ứng
Các yếu tố ảnh hưởng đến tốc độ phản ứng được vận dụng một cách thích hợp sẽ tăng hiệu quả các hoạt động trong đời sống và sản xuất.

|

|
1. Tốc độ phản ứng là đại lượng chỉ mức độ nhanh hay chậm của một phản ứng hoá học.
2. Các yếu tố ảnh hưởng đến tốc độ phản ứng:
- Diện tích bề mặt tiếp xúc: Diện tích bề mặt tiếp xúc càng lớn, tốc độ phản ứng càng nhanh.
- Nhiệt độ: Khi tăng nhiệt độ, phản ứng diễn ra với tốc độ nhanh hơn.
- Nồng độ: Nồng độ các chất phản ứng càng cao, tốc độ phản ứng càng nhanh.
- Chất xúc tác làm tăng tốc độ phản ứng nhưng không bị thay đổi cả về lượng và chất sau phản ứng.
- Chất ức chế làm giảm tốc độ phản ứng.
Bạn có thể đăng câu hỏi về bài học này ở đây
